Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
уксусная кислота
Синонимы и иностранные названия:
acetic acid (англ.)
ethanoic acid (англ.)
ледяная уксусная кислота (рус.)
этановая кислота (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. прозрачн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
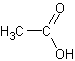
C2H4O2Формула в виде текста:
CH3COOHМолекулярная масса (в а.е.м.): 60,052
Температура плавления (в °C):
16,64 [Лит.]
Температура кипения (в °C):
117,8 [Лит.]
Температура вспышки (в °C):
41,7
Температура самовоспламенения в воздухе (в °C):
566 (пары в воздухе)
Температуры плавления под давлением (в °C):
37 (100 МПа)
Температурные константы смесей (содержание в весовых процентах):
-26,7 °C (температура плавления эвтектической смеси) вода 40% уксусная кислота 60%
Растворимость (в г/100 г растворителя или характеристика):
1,2-дихлорэтан: смешивается [Лит.]
аммиак жидкий: растворим [Лит.]
ацетон: смешивается [Лит.]
бензол: смешивается [Лит.]
вода: 203 (-20°C) [Лит.]
вода: 669 (0°C) [Лит.]
вода: смешивается (16,6°C) [Лит.]
глицерин: смешивается [Лит.]
диэтиловый эфир: смешивается [Лит.]
сероуглерод: растворим [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: смешивается [Лит.]
этанол 98,9%: 35,1 (-75°C) [Лит.]
этанол 98,9%: 378,5 (0°C) [Лит.]
этанол 98,9%: смешивается (16,6°C) [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
вода 71,5%, уксусная кислота 28,5%, -10 °C, отделяющаяся фаза: H2O [Лит.]
вода 50,8%, уксусная кислота 49,2%, -20 °C, отделяющаяся фаза: H2O [Лит.]
вода 40%, уксусная кислота 60%, -26,7 °C, отделяющаяся фаза: CH3COOH + H2O [Лит.]
вода 33%, уксусная кислота 67%, -20 °C, отделяющаяся фаза: CH3COOH [Лит.]
вода 22,5%, уксусная кислота 77,5%, -10 °C, отделяющаяся фаза: CH3COOH [Лит.]
вода 13%, уксусная кислота 87%, 0 °C, отделяющаяся фаза: CH3COOH [Лит.]
Плотность:
1,0492 (20°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
гигроскопичен
вкус: кислый
запах: резкий
Некоторые числовые свойства вещества:
Криоскопическая константа (К·кг/моль): 3,9
Нижний концентрационный предел взрываемости газов, паров или пыли в воздухе (%): 5,4
Порог восприятия запаха в воздухе (мг/л): 0,0006
Эбулиоскопическая постоянная (К·кг/моль): 2,53
Нормативные документы, связанные с веществом:
- ГОСТ № 32384-2013 "Уксусная кислота. Определение содержания в атмосферном воздухе методом газовой хроматографии"
- ГОСТ № 61-75 "Реактивы. Кислота уксусная. Технические условия."
- МУК № 4.1.638-96 "Методические указания по газохроматографическому определению уксусной кислоты в атмосферном воздухе"
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица III, с концентрацией 80% и более)
Используется для синтеза веществ:
1-фенилпропан-2-он
бромуксусная кислота
хлоруксусная кислота α-форма
этан-1,2-диаминия диэтаноат
этанамид
Реакции вещества:
- С формальдегидом в присутствии катализатора дает акриловую кислоту. [Лит.]
- Реагирует с ацетиленом в присутствии солей ртути(II) с образованием винилацетата. [Лит.]
- Реагирует с ацетиленом в присутствии трет-бутилпероксида с образованием адипиновой кислоты. [Лит.]
- Реагирует с основными оксидами и гидроксидами с образованием ацетатов и воды. [Лит.]
- В разбавленных водных растворах энергично реагирует с магнием и цинком. [Лит.]
- Реагирует с железом и свинцом с образованием ацетатов и выделением водорода. В присутствии кислорода реакция ускоряется. [Лит.]
- Изопропенилацетат может быть получен реакцией пропина с уксусной кислотой в присутствии эфирата трифторида бора. [Лит.1]
CH3C≡CH + CH3COOH → CH3COOC(CH3)=CH2
- Тетрахлорид кремния реагирует с уксусной кислотой с образованием тетраацетата кремния и хлороводорода. Реакция лучше идет в органическом растворителе. Максимальный выход в смеси бензола и пиридина. Выход 96,9%. [Лит.1, Лит.2, Лит.3
 ]
]
SiCl4 + 4CH3COOH → (CH3COO)4Si + 4HCl
- Диацетат-гидроксид алюминия получают растворением гидроксида алюминия в 30% водном растворе уксусной кислоты. [Лит.1
 ]
]
Al(OH)3 + 2CH3COOH → (CH3COO)2AlOH + 2H2O
- Циклопропанон присоединяет уксусную кислоту с образованием 1-ацетоксициклопропан-1-ола. Выход 100%. [Лит.1]
- Ацетат натрия с уксусной и муравьиной кислотами дает аддукты. [Лит.1]
- Действие безводной серной кислоты на уксусную кислоту ведет к образованию сульфоуксусной кислоты. [Лит.1]
- Пероксид натрия воспламеняет глицерин, ледяную уксусную кислоту, молочную кислоту, параформальдегид, миндальное масло и диэтиловый эфир. [Лит.1]
- Пероксид натрия способен воспламенять при контакте: метанол, этанол, пропанол, бутанол, изоамиловый спирт, бензиловый спирт, этиленгликоль, диэтиловый эфир, анилин, скипидар, уксусную кислоту. [Лит.1]
- Хромовый ангидрид воспламеняет при контакте: метанол, этанол, бутанол, изоамиловый спирт, изобутанол, диэтиловый эфир, уксусную кислоту, ацетон, ацетальдегид, бутаналь, бензальдегид, пропаналь, паральдегид, этилацетат, амилацетат, пеларгоновую кислоту. [Лит.1]
- Алюминий растворяется в разбавленных уксусной и лимонной кислотах при 100 С, реакция ускоряется в присутствии хлоридов. [Лит.1]
- При действии безводной уксусной кислоты и уксусного ангидрида на тетрахлорид титана образуется диацетат-дихлорид титана(IV). [Лит.1, Лит.2
 ]
] - При длительном кипячении оксида ртути(II) с этанолом в присутствии едкого натра образуется меркарбид (выход 55%). Тот же меркарбид получен при реакции с пропиловым (выход 34,87%) аллиловым, бутиловым (выход 14,96%), амиловыми спиртами, уксусной кислотой, крахмалом, тростниковым сахаром, целлюлозой. [Лит.1
 , Лит.2, Лит.3
, Лит.2, Лит.3 ]
] - Тетраацетат свинца получают реакцией сурика с уксусной кислотой и уксусным ангидридом. Выход 70-77%. [Лит.1
 ]
]
Pb3O4 + 8CH3COOH → Pb(CH3COO)4 + 2Pb(CH3COO)2
- Тетраацетат свинца получают реакцией сурика с уксусной кислотой и уксусным ангидридом и доокислением ацетата свинца(II) хлором. [Лит.1
 , Лит.2
, Лит.2 ]
]
Реакции, в которых вещество не участвует:
- Безводная уксусная кислота или ее спиртовый раствор не реагирует с карбонатами. [Лит.]
- Не окисляется оксидом селена(IV) даже при длительном кипячении. [Лит.]
Показатель преломления (для D-линии натрия):
1,3720 (20°C)
Давление паров (в мм рт.ст.):
10 (17,1°C)
40 (42,4°C)
100 (62,2°C)
400 (98,1°C)
560 (109°C)
1520 (143,5°C)
3800 (180,3°C)
Свойства растворов:
0,5% (вес.), растворитель - вода
Температура замерзания (°C) = -0,16
Электропроводность (мСм/см) = 0,3 (20°)
6% (вес.), растворитель - вода
Плотность (г/см3) = 1,0069 (20°)
Температура замерзания (°C) = -1,9
6,5% (вес.), растворитель - вода
Температура замерзания (°C) = -2,09
10% (вес.), растворитель - вода
Плотность (г/см3) = 1,0126 (20°)
Поверхностное натяжение на границе с воздухом (мН/м) = 51,4 (30°)
Температура замерзания (°C) = -3,23
Электропроводность (мСм/см) = 1,5 (20°)
16,21% (вес.), растворитель - вода
Температура замерзания (°C) = -5,2
20% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,431 (20°)
Плотность (г/см3) = 1,0261 (20°)
Показатель преломления для D-линии натрия = 1,3472 (20°)
Температура замерзания (°C) = -6,81
Электропроводность (мСм/см) = 1,7 (20°)
30% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,669 (20°)
Плотность (г/см3) = 1,0383 (20°)
Показатель преломления для D-линии натрия = 1,3537 (20°)
Температура замерзания (°C) = -10,84
30,1% (вес.), растворитель - вода
Температура замерзания (°C) = -10,9
40% (вес.), растворитель - вода
Плотность (г/см3) = 1,0488 (20°)
Электропроводность (мСм/см) = 1,1 (20°)
41,5% (вес.), растворитель - вода
Температура замерзания (°C) = -15,9
50% (вес.), растворитель - вода
Плотность (г/см3) = 1,0575 (20°)
50,6% (вес.), растворитель - вода
Температура замерзания (°C) = -19,8
55,5% (вес.), растворитель - вода
Температура замерзания (°C) = -22,3
60% (вес.), растворитель - вода
Плотность (г/см3) = 1,0642 (20°)
61,86% (вес.), растворитель - вода
Температура замерзания (°C) = -24,2
66,44% (вес.), растворитель - вода
Температура замерзания (°C) = -20,5
69% (вес.), растворитель - вода
Температура кипения (°C) = 103,2
70% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 2,629 (20°)
Плотность (г/см3) = 1,0686 (20°)
Показатель преломления для D-линии натрия = 1,3738 (20°)
Температура вспышки (°C) = 63
Температура самовоспламенения (°C) = 500
72% (вес.), растворитель - вода
Плотность (г/см3) = 1,0691 (20°)
74% (вес.), растворитель - вода
Плотность (г/см3) = 1,0695 (20°)
76% (вес.), растворитель - вода
Плотность (г/см3) = 1,0699 (20°)
77% (вес.), растворитель - вода
Плотность (г/см3) = 1,07 (20°)
Температура кипения (°C) = 104,4
78% (вес.), растворитель - вода
Плотность (г/см3) = 1,07 (20°)
80% (вес.), растворитель - вода
Плотность (г/см3) = 1,0699 (20°)
80,65% (вес.), растворитель - вода
Температура замерзания (°C) = -7,4
82% (вес.), растворитель - вода
Плотность (г/см3) = 1,0696 (20°)
84% (вес.), растворитель - вода
Плотность (г/см3) = 1,0691 (20°)
86% (вес.), растворитель - вода
Плотность (г/см3) = 1,0684 (20°)
88% (вес.), растворитель - вода
Плотность (г/см3) = 1,0674 (20°)
90% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 2,386 (20°)
Плотность (г/см3) = 1,066 (20°)
Показатель преломления для D-линии натрия = 1,3771 (20°)
90,09% (вес.), растворитель - вода
Температура замерзания (°C) = 3,6
92% (вес.), растворитель - вода
Плотность (г/см3) = 1,0643 (20°)
94% (вес.), растворитель - вода
Плотность (г/см3) = 1,062 (20°)
96% (вес.), растворитель - вода
Плотность (г/см3) = 1,0589 (20°)
Температура замерзания (°C) = 10,34
97% (вес.), растворитель - вода
Плотность (г/см3) = 1,057 (20°)
Температура замерзания (°C) = 11,68
98% (вес.), растворитель - вода
Плотность (г/см3) = 1,0549 (20°)
99% (вес.), растворитель - вода
Плотность (г/см3) = 1,0525 (20°)
Температура замерзания (°C) = 14,74
Показатели диссоциации:
pKBH+ (1) = -6,2 (25°C, вода)
pKa (1) = 4,756 (25°C, вода)
pKa (1) = 11,4 (25°C, диметилсульфоксид)
Индекс удерживания для газовой хроматографии:
633 (фаза колонки - полидиметилсилоксан)
622,3 (фаза колонки - полидиметилсилоксан с 5% фенильных групп)
Диэлектрическая проницаемость:
6,15 (20°C)
Дипольный момент молекулы (в дебаях):
1,74 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,232 (20°C)
1,155 (25,2°C)
0,79 (50°C)
Поверхностное натяжение (в мН/м):
27,8 (20°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
2,01 (17°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-487 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-392,5 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
159,8 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
123,4 (ж)Энтальпия плавления ΔHпл (кДж/моль):
11,53Температура вспышки в воздухе (°C):
38Температура самовоспламенения на воздухе (°C):
454Теплота сгорания (кДж/моль):
876,1Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-432,2 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-374,2 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
283,5 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
63,4 (г)Энтальпия растворения ΔHраств (кДж)
1,536 (ж) [растворитель: вода, 18°C, 1 моль в 6400 молях воды] [Лит.]
-9,68 (ж) [растворитель: азотная кислота, 25°C, 1 моль в 1 моле азотной кислоты] [Лит.]
Летальная доза (ЛД50, в мг/кг):
3310 (крысы, перорально)
525 (мыши, внутривенно)
Природные и антропогенные источники:
Очень распространена в растительном и животном мире. Многие микроорганизмы, грибки и бактерии способны расщеплять органические вещества до уксусной кислоты.
Критическая температура (в °C):
321,6Критическое давление (в МПа):
5,79Критическая плотность (в г/см3):
0,3506Критический объем (см3/моль):
171,1Применение:
Вкусовое вещество. Для синтеза душистых веществ, красителей, ацетона, ацетата целлюлозы. Используется в крашении и печатании.
История:
Известна с древности в виде винного уксуса. По рассказам Плиния Клеопатра пила напиток, приготовленный растворением жемчуга в уксусе. Однако концентрированная уксусная кислота была получена около 200 лет назад.
Дополнительная информация::
Существует в виде димеров циклической или линейной формы. В безводном состоянии застывает в кристаллы похожие на лёд и поэтому называется "ледяной" уксусной кислотой. Ассоциирована. Разъедает кожу.
Типичная карбоновая кислота. Соли называются ацетатами. Растворяет многие металлы, их оксиды, карбонаты с образованием солей. Окислители ускоряют реакцию. Так, например, кобальт легко растворяется в уксусной кислоте в присутствии нитрата кобальта или перекиси водорода.
Дополнительная информация:
Не дает азеотропных смесей с водой, 1,2-дихлорэтаном, ацетамидом, этилнитратом, иодэтаном, этанолом, диметилсульфидом, метилхлорацетатом, 1,2,3-трихлорпропаном, 3-бромпропеном, ацетоном, пропионовой кислотой, метилацетатом, 1,3-дибромпропаном, 1-хлорпропаном, 2-хлорпропаном, 1-бромпропаном, 2-бромпропаном, 1-пропанолом, винилацетатом, уксусным ангидридом, 2-бутаноном, масляной кислотой, этилацетатом, диэтиловым эфиром, циклопентаном, 3-пентаноном, валериановой кислотой, диэтоксиметаном, фторбензолом, анилином, метилциклопентаном, бензойной кислотой, салициловой кислотой, бензилхлоридом, дибутиловым эфиром.
Ассоциирована в жидком виде, в парах и в неполярных растворителях. Существует преимущественно в виде димеров, за счет водородной связи между молекулами. В водном растворе ассоциаты распадаются на гидратированные молекулы.
Слабая одноосновная кислота. В водном растворе уксусная кислота вытесняет угольную кислоту из солей, в водно-спиртовом растворе углекислый газ вытесняет уксусную кислоту из солей.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 3-4
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 15-16
- Milne G.W.A. Gardner's Commercially Important Chemicals. - Wiley-Interscience, 2005. - С. 6
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 101-117
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. - М.-Л.: Химия, 1964. - С. 118
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.2. - Л.: Химия, 1976. - С. 5-6
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 229
- Каррер П. Курс органической химии. - 2-е изд., под ред. Колосова М.Н. - Л.: ГНТИХЛ, 1962. - С. 249-250
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. - 2 изд, Ч.2. - М.: Ассоциация Пожнаука, 2004. - С. 567-568
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 563
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 186
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. - 2-е изд., Ч.1. - М.: Бином. Лаборатория знаний, 2005. - С. 223
- Реформатский С.Н. Начальный курс органической химии. - М.-Л.: ГИ, 1930. - С. 318-320
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1188-1193
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 1020-1021
- Фролов Г.М., Шабуров М.А. Производство уксусной кислоты. - 3 изд. - М.: Лесная промышленность, 1978
- Хёрд Ч.Д. Пиролиз соединений углерода. - Л.-М.: ГОНТИ РКТП СССР, 1938. - С. 315-318
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 32-33
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер