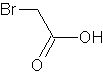

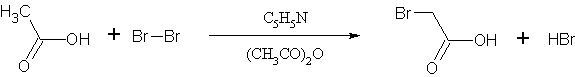
В 3-литровую колбу, снабженную капельной воронкой, конец которой погружен в жидкость, и обратным холодильником, защищенным хлоркальциевой трубкой (примечание 2), помещают смесь 1 л (17,5 моля, избыток) ледяной уксусной кислоты, 200 мл уксусного ангидрида и 1 мл пиридина. Прибавляют несколько стеклянных бусинок и смесь нагревают до кипения. После этого источник нагревания удаляют, прибавляют к смеси около 1 мл брома и предоставляют реакции идти до тех пор, пока жидкость не станет бесцветной (примечание 3). Затем прибавляют остальное количество брома, равное 1124 г (360 мл, 7,03 моля; примечание 4), с такой скоростью, с какой он будет вступать в реакцию (примечание 5); в продолжение этого периода (около 2,5 часа) с помощью горелки поддерживают слабое кипение реакционной массы. Когда будет прибавлено около половины брома, жидкость окрашивается в вишневый цвет, который сохраняется в течение остального времени бромирования. После прибавления всего брома смесь нагревают до тех пор, пока она не станет бесцветной. Затем смеси дают охладиться и медленно прибавляют к ней 75 мл воды, чтобы гидролизовать уксусный ангидрид. Избыток уксусной кислоты и воду отгоняют на кипящей водяной бане при давлении около 35 мм. Когда выпаривание будет закончено, остаток при охлаждении начинает кристаллизоваться; выход чистой бромуксусной кислоты, из которой почти целиком состоит этот остаток, равен 845—895 г (примечание 6).
Примечания
2. Рекомендуется работать с цельноспаянным стеклянным прибором. Если это невозможно, применяют асбестовые пробки с одним отверстием. Для приготовления таких пробок полоски асбеста пропитывают водой и оборачивают ими стеклянные трубки нужного размера до тех пор, пока не будет достигнут желаемый диаметр, после чего пробки сушат при 110°.
3. Индукционный период до начала реакции и до исчезновения окраски, вызванной бромом, продолжается около 10 мин.
4. Химически чистый бром можно применять непосредственно. Технический бром следует высушить взбалтыванием с концентрированной серной кислотой.
5. Бром следует прибавлять не слишком быстро, так, чтобы не было потерь через холодильник.
6. Чистую бромуксусную кислоту можно получить перегонкой сырого препарата из колбы Клайзена, которую погружают в масляную баню и снабжают закутанным елочным дефлегматором высотой 20 см. Собирают фракцию с т. кип. 108—110° (30 мм). Выход составляет 775—825 г (80—85% теоретич.).