Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
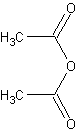
уксусной кислоты ангидрид
Синонимы и иностранные названия:
acetic anhydride (англ.)
ацетангидрид (рус.)
оцтовий ангiдрид (укр.)
уксусный ангидрид (рус.)
этановой кислоты ангидрид (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C4H6O3Формула в виде текста:
(CH3CO)2OМолекулярная масса (в а.е.м.): 102,089
Температура плавления (в °C):
-73,1Температура кипения (в °C):
139,6Растворимость (в г/100 г растворителя или характеристика):
бензол: растворим [Лит.]
вода: 13,6 (20°C) [Лит.]
вода: реагирует (100°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
сульфолан: смешивается [Лит.]
тетрагидрофуран: растворим [Лит.]
тетрахлорметан: мало растворим [Лит.]
уксусная кислота: растворим [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: реагирует [Лит.]
Плотность:
1,082 (20°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
запах: резкий
Некоторые числовые свойства вещества:
Порог восприятия запаха в воздухе (мг/л): 0,00049
Нормативные документы, связанные с веществом:
- Постановление правительства РФ № 1020 от 08.10.2012 "Об утверждении крупного и особо крупного размеров прекурсоров наркотических средств или психотропных веществ, а также крупного и особо крупного размеров для растений, содержащих прекурсоры наркотических средств или психотропных веществ, либо их частей, содержащих прекурсоры наркотических средств или психотропных веществ, для целей статей 228_3, 228_4 и 229_1 Уголовного кодекса Российской Федерации"
- крупный размер (г, свыше) = 100 (в концентрации 10 процентов или более, с изменениями на 09.04.2015)
- особо крупный размер (г, свыше) = 5000 (в концентрации 10 процентов или более, с изменениями на 09.04.2015)
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица I, с концентрацией 10% и более, с изменениями на 09.04.2015)
- Постановление правительства РФ № 964 от 29.12.2007 "Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации" (Описание документа: Списки ядовитых и сильнодействующих веществ.)
Используется для синтеза веществ:
1-(3,4-диметоксифенил)этанон
1-(4-бромфенил)этанон
ацетилнитрат
бензойной кислоты ангидрид
тетранитрометан
Реакции вещества:
- Коричную кислоту получают реакцией бензальдегида и уксусного ангидрида в присутствии ацетата калия при 175-180 С в течение 5 часов. Выход 55-60%. Название реакции: реакция Перкина. [Лит.1
 ]
]
C6H5CHO + (CH3CO)2O → C6H5CH=CHCOOH + CH3COOH
- Гиппуровая кислота реагирует с уксусным ангидридом в присутствии 3-метилпиридина при комнатной температуре в водном растворе в течение 2 часов с образованием N-бензоиламиноацетона. Выход 77%. Название реакции: реакция Дакина-Веста. [Лит.1]
C6H5CONHCH2COOH + (CH3CO)2O → C6H5NHCH2COCH3 + CH3COOH + CO2
- Фенилаланин реагирует с уксусным ангидридом в присутствии пиридина при 100 С в течение 5 часов с образованием 3-(N-ацетиламино)-4-фенилбутан-2-она. Выход 79%. Название реакции: реакция Дакина-Веста. [Лит.1, Лит.2]
NH2CH(CH2C6H5)COOH + (CH3CO)2O → CH3CONHCH(CH2C6H5)COCH3 + CH3COOH + CO2
- 1-Ацетокси-1-бутен можно получить при кипячении в течение 4 часов масляного альдегида с уксусным ангидридом в присутствии ацетата калия. Выход 45,5%. [Лит.1]
CH3CH2CH2CHO + (CH3CO)2O → CH3CH2CH=CHOC(O)CH3 + CH3COOH
- Триацетат алюминия можно получить реакцией изопропоксида алюминия с уксусным ангидридом. [Лит.1
 ]
]
((CH3)2CHO)3Al + 3(CH3CO)2O → (CH3COO)3Al + 3CH3COOCH(CH3)2
- Нагреванием 2-гидроксибензальдегида с уксусным ангидридом и ацетатом натрия получают кумарин. [Лит.1]
- Уксусный ангидрид окисляется тетраацетатом свинца при кипячении с образованием O-ацетилгликолевого ангидрида. Выход 40%. [Лит.1]
- Ацетат сурьмы(III) получают кипячением оксида сурьмы(III) с уксусным ангидридом. [Лит.1]
- При реакции d-катехина с уксусным ангидридом и ацетатом натрия образуется пентаацетил-d-катехин. [Лит.1]
- Нагревание индолилуксусной кислоты с уксусным ангидридом в присутствии ацетата натрия при 135-140 С в течение 18 часов дает (1-ацетил-3-индолил)ацетон. [Лит.1
 ]
] - Ацетат алюминия получают реакцией безводного хлорида алюминия с уксусным ангидридом. [Лит.1
 , Лит.2]
, Лит.2]
Показатель преломления (для D-линии натрия):
1,3904 (20°C)
Давление паров (в мм рт.ст.):
15 (44,6°C)
100 (82,2°C)
Диэлектрическая проницаемость:
20,7 (18,5°C)
Дипольный момент молекулы (в дебаях):
2,82 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,9 (18°C)
0,49 (100°C)
Поверхностное натяжение (в мН/м):
32,7 (20°C)
31,22 (30°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-624,42 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-489,14 (ж)Энтальпия кипения ΔHкип (кДж/моль):
276,7Температура вспышки в воздухе (°C):
40Температура самовоспламенения на воздухе (°C):
360Теплота сгорания (кДж/моль):
1807Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-576,1 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-477 (г)Летальная доза (ЛД50, в мг/кг):
1780 (крысы, перорально)
Разные дозы:
ПДКатмосф. = 30 мг/л.
Симптомы острого отравления:
Раздражает глаза и дыхательные пути, вызывает ожоги кожи.
Критическая температура (в °C):
295,8Критическое давление (в МПа):
4,68Применение:
Применяется как ацетилирующий агент в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (напр. аспирина), красителей, душистых веществ, хлористого ацетила.
Дополнительная информация::
Медленно реагирует с водой с образованием уксусной кислоты. С основаниями дает ацетаты, с хлороводородом и фосгеном при 70-80 С - ацетилхлорид, со спиртами - сложные эфиры, с тиолами - тиоэфиры, с аминами - амиды, с альдегидами в присутствии кислых катализаторов - диацетаты, с ароматическими альдегидами в присутствии ацетата калия - бета-арилакриловые кислоты. Ацетилирует целлюлозу, превращает высшие жирные кислоты в ангидриды, алифатические и жирноароматические кетоны в присутствии трифторида бора - в бета-дикетоны.
Мировое производство 1,1-1,3 млн. тонн (1988 г).
Источники информации:
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 19
- Milne G.W.A. Gardner's Commercially Important Chemicals. - Wiley-Interscience, 2005. - С. 6-7
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 222-223
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров. - М.: МЦФЭР, 2000. - С. 147
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.2. - Л.: Химия, 1976. - С. 6
- Гутман В. Химия координационных соединений в неводных растворах. - М.: Мир, 1971. - С. 168-169 (уксусный ангидрид как растворитель)
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 563
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 126
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 394
- Хёрд Ч.Д. Пиролиз соединений углерода. - Л.-М.: ГОНТИ РКТП СССР, 1938. - С. 565-566
- Химическая энциклопедия. - Т. 3. - М.: Советская энциклопедия, 1992. - С. 180
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 33
- Юкельсон И.И. Технология основного органического синтеза. - М.: Химия, 1968. - С. 619-623
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер