Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
сера ромбическая
Синонимы и иностранные названия:
sulfur orthorhombic (англ.)
sulfur rhombic (англ.)
цикло-октасера (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
ромбическая сераТип вещества:
неорганическое
Внешний вид:
желт. ромбические кристаллы
Внешний вид при разных температурах:
светло-желт. ромбические кристаллы
бесцветн. кристаллы (-50°C)
желт. подвижная жидкость (113°C)
темно-коричнев. вязкая жидкость (160-300°C)
темно-коричнев. подвижная жидкость (300-444°C)
оранжево-желт. газ (445°C)
соломенно-желт. газ (650°C)
Фотографии вещества:
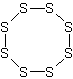
Кристаллические модификации, структура молекулы, цвет растворов и паров:
Существует в ромбической (альфа-форма, плотность 2,07 г/см3, т.пл. 112,8 С, на фото), моноклинной (бета-форма, плотность 1,96 г/см3, т.пл. 119,3 С), аморфной (плотность 1,92 г/см3) модификациях. Альфа переходит в бета при 95,4 С. При охлаждении в жидком воздухе желтые кристаллы серы становятся белыми. Гамма-моноклинную форму впервые наблюдал в 1890 г. В. Мутман. Ее можно получить медленным охлаждением расплава серы нагретого до 150 С, или охлаждением горячих концентрированных растворов серы в этаноле, сероуглероде или углеводородах. Плотность свето-желтой гамма-формы 2,19 г/см3, при комнатной температуре она медленно превращается в ромбическую форму, быстрое нагревание ведет к ее плавлению при 106,8 С.
Цвет паров зависит от соотношения различных форм серы в парах. До 600 С цвет пара зеленый. При пониженном давлении (1 мм.рт.ст.) и 730 С цвет пара фиолетовый из-за большого содержания S2. При 440 С и 10 мм.рт.ст. цвет пара вишнево-красный из-за образования S3.
Брутто-формула (по системе Хилла для органических веществ):
S8Формула в виде текста:
S8Молекулярная масса (в а.е.м.): 256,52
Температура плавления (в °C):
112,8Температура кипения (в °C):
444,6Температуры полиморфных переходов (в °C):
ромбические крист. (α) в моноклинные крист. (β) = 95,39°C
Температурные константы смесей (содержание в весовых процентах):
65 °C (температура плавления эвтектической смеси) иод 20% сера ромбическая 80%
91,5 °C (температура плавления эвтектической смеси) гептатиазоцин 54% сера ромбическая 46%
Растворимость (в г/100 г растворителя или характеристика):
1,2-дихлорэтан: 0,833 (25°C) [Лит.]
1,2-дихлорэтан: 11,07 (97,5°C) [Лит.]
амиловый спирт: 1,5 (95°C) [Лит.]
аммиак жидкий: 62,87 (-78°C) [Лит.]
аммиак жидкий: 47,8 (0°C) [под давлением] [Лит.]
аммиак жидкий: 34,5 (16,4°C) [под давлением] [Лит.]
аммиак жидкий: 30,4 (25°C) [под давлением] [Лит.]
аммиак жидкий: 23 (40°C) [под давлением] [Лит.]
анилин: 85,96 (130°C) [Лит.]
ацетон: 2,5 (25°C) [Лит.]
бензин: 4,38 (21°C) [Лит.]
бензин: 6,96 (26°C) [Лит.]
бензол: 1 (0°C) [Лит.]
бензол: 1,2 (8°C) [Лит.]
бензол: 2,1 (25°C) [Лит.]
бензол: 4,5 (50°C) [Лит.]
бензол: 8,7 (70°C) [Лит.]
бромоформ: 3,78 (5,6°C) [Лит.]
вода: 0,0000005 (25°C) [Лит.]
гексан: 0,07 (-20°C) [Лит.]
гексан: 0,16 (0°C) [Лит.]
гексан: 0,25 (20°C) [Лит.]
гексан: 0,55 (40°C) [Лит.]
гексан: 2,88 (100°C) [Лит.]
гептан: плохо растворим [Лит.]
гидразин: растворим с реакцией 54 [Лит.]
диоксид серы: не растворим [Лит.]
дихлорид дисеры: 7,3 (-20°C) [Лит.]
дихлорид дисеры: 13,28 (0°C) [Лит.]
дихлорид дисеры: 25,52 (20°C) [Лит.]
дихлорид дисеры: 51,5 (40°C) [Лит.]
диэтиловый эфир: 0,187 (13°C) [Лит.]
диэтиловый эфир: 0,283 (23°C) [Лит.]
иод жидкий: растворим [Лит.]
керосин: 16,1 (158°C) [Лит.]
льняное масло: 0,9 (5°C) [Лит.]
метанол: 0,028 (18,5°C) [Лит.]
метиламин: легко растворим [Лит.]
пентахлорэтан: 1,197 (25°C) [Лит.]
пиридин: 1,5 (20°C) [Лит.]
пиридин: 11,7 (84,5°C) [Лит.]
сероуглерод: 1,05 (-109,5°C) [Лит.]
сероуглерод: 3,674 (-65°C) [Лит.]
сероуглерод: 10,96 (-25°C) [Лит.]
сероуглерод: 16,54 (-11°C) [Лит.]
сероуглерод: 22 (0°C) [Лит.]
сероуглерод: 46,55 (22°C) [Лит.]
сероуглерод: 50,4 (25°C) [Лит.]
сероуглерод: 143,9 (50°C) [Лит.]
сероуглерод: 257,1 (70°C) [Лит.]
скипидар: 1,35 (10°C) [Лит.]
тетрахлорид олова: 5,8 (99°C) [Лит.]
тетрахлорметан: 0,148 (-24°C) [Лит.]
тетрахлорметан: 0,34 (0°C) [Лит.]
тетрахлорметан: 0,84 (25°C) [Лит.]
тетрахлорметан: 1,83 (50°C) [Лит.]
тетрахлорэтилен: 1,53 (25°C) [Лит.]
толуол: 0,91 (0°C) [Лит.]
толуол: 1,82 (20°C) [Лит.]
толуол: 3,21 (40°C) [Лит.]
толуол: 6,3 (60°C) [Лит.]
триметиламин: мало растворим [Лит.]
трихлорид мышьяка: хорошо растворим [Лит.]
трихлорэтилен: 1,63 (25°C) [Лит.]
фенол: 16,35 (174°C) [Лит.]
фтороводород: не растворим [Лит.]
хлороформ: 0,8 (13°C) [Лит.]
хлороформ: 1,23 (24°C) [Лит.]
этанол: 0,065 (25°C) [Лит.]
этанол абсолютный: 0,051 (15°C) [Лит.]
этанол абсолютный: 0,053 (18,5°C) [Лит.]
этанол абсолютный: 0,42 (78°C) [Лит.]
этилацетат: растворим [Лит.]
Цвет растворов:
красн. (растворитель: пиперидин)
Плотность:
2,07 (20°C, г/см3, состояние вещества - кристаллы)
1,7988 (125°C, относительно воды при 4°C, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Удельное электрическое сопротивление (МОм · м): 2,8 (при 300 С)
Удельное электрическое сопротивление (МОм · м): 73900 (при 110 С)
Удельное электрическое сопротивление (МОм · м): 200 (при 130 С)
Удельное электрическое сопротивление (ТОм · м): 1910 (при 20 С)
Электроотрицательность по Полингу: 2,58
Способы получения:
- Реакцией сероводорода с диоксидом серы в присутствии катализаторов на основе оксидов железа и алюминия. [Лит.]
Реакции вещества:
- При 360°С горит на воздухе (или при 280°С в кислороде) с образованием преимущественно оксида серы(IV), с примесью оксида серы(VI). [Лит.]
S + O2 → SO2
- Концентрированной азотной кислотой окисляется до серной кислоты. [Лит.]
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
- Реагирует с 1,1-диметилгидразином с образованием термически нестабильного темно-пурпурного N,N-диметилтионитрозиламина (CH3)2NNS. [Лит.]
- Реагирует с нитритами в ацетоне, диметилформамиде или диметилсульфоксиде давая красный анион дитионитрита (SSNO)-. [Лит.]
- Реагирует с сульфатом серебра при 200 С, с сульфатом меди(II) - при 300 С, с сульфатом свинца(II) - при 500 С, с сульфатом бария - при 800 С, с сульфатами рубидия и цезия - при 900 С. [Лит.]
- Реагирует с оксидом селена(IV) при 280-500 С, с оксидами никеля(II), молибдена(VI), вольфрама(VI) - при 850 С, с оксидом меди(II) - при 400 С, с оксидами кадмия, свинца(II), кобальта(II,III) - при 600 С, с оксидом марганца(III) - при 650 С, с оксидом железа(III) - при 800 С. [Лит.]
- При 650-750 С пары серы реагируют с этаном и пропаном при времени контакта 0,04-0,1 с с образованием этилена и пропилена соответственно. (выход 65%) [Лит.]
- Реагирует с полиэтиленом при 200-250 С с внедрением серы в C-H-связи с последующим образованием поперечных связей между цепями полиэтилена. Предельно присоединяется 31-37% серы. [Лит.]
- Реагирует при кипячении с масляной кислотой с образованием тиофена, загрязненого сероуглеродом. [Лит.]
- Реагирует при кипячении с кротоновой кислотой с образованием тиофена и сероуглерода. [Лит.]
- Реагирует с хлорбензолом при 250-350 С под давлением с образованием полифениленполисульфидов и хлороводорода. [Лит.]
- Реагирует при кипячении с анилином с образованием ди(4-аминофенил)сульфида и сероводорода. [Лит.]
- Реагирует с коричной кислотой с образованием 2,5-дифенилтиофена, углекислого газа и сероводорода. [Лит.]
- Выше 180 С реагирует с иодбензолом с образованием дифенилполисульфидов и иода. [Лит.]
- При нагревании с гексафторбензолом образует дифторид дисеры и смесь бис(пентафторфенил)сульфида и бис(пентафторфенил)дисульфида. [Лит.]
- Реагирует с ацетофеноном при 155-175 С с образованием 1,4-дифенилбутан-1,4-диона. [Лит.]
- Нагревание ди-, три- и пентахлорбифенилов с избытком серы при 300 С приводит к полному замещению хлоров на серу с образованием нетоксичных бифениленполисульфидов. [Лит.]
- Реагирует с анилином и сероуглеродом при 260 °С в течение 3 часов с образованием 2-меркаптобензотиазола. [Лит.]
- При нагревании с безводным глицерином образуется тиоглицериновая кислота. [Лит.]
- При 290-300 С образует с глицерином аллилмеркаптан и диаллилгексасульфид. [Лит.]
- Сплавление серы с сахарозой дает обильное выделение сероводорода. [Лит.]
- При нагревании реагирует с растворами щелочей давая сначала сульфиты и сульфиды, а при избытке серы - полисульфиды и тиосульфаты. Реакция ускоряется в присутствии спирта, который улучшает смачивание серы раствором щелочи. [Лит.]
- При быстром охлаждении расплавленной серы, нагретой до кипения, образуется пластическая сера, образованная спиральными цепями из атомов серы. Тонкие нити пластической серы можно растянуть в 15 раз. Пластическая сера постепенно переходит в ромбическую серу. [Лит.]
- При комнатной температуре реагирует с озоном. [Лит.]
- Сера растворяется в жидком броме с образованием дибромида дисеры S2Br2, легко диссоциирующего на элементы. [Лит.]
- Окисление серы воздухом при комнатной температуре идет медленно, хотя образуются следы диоксида серы. Температура воспламенения серы на воздухе равна 250-260 С. [Лит.]
- Реагирует с раствором гексафторарсената(V) серебра(I) в диоксиде серы с образованием комплексоной соли гексафторарсената(V) бис(октасера)серебра(I). [Лит.]
- Катионы серы образующиеся при реакции триоксида серы с серой нестабильны и постепенно разлагаются с выделением диоксида серы. Синий продукт полученный реакцией серы с триоксидом серы и описываемый как S2O3 по-видимому представляет собой смесь S8(HS3O10)2 и S4(S4O13). [Лит.]
- Сера растворяется в олеуме с образованием прозрачных, ярко-окрашенных растворов катионов серы желтого S42+, темно-синего S82+ или красного S192+ цвета. В 5% олеуме в основном образуется S192+, в 10-15% - смесь S192+ и S82+, в 45-65% - смесь S82+ и S42+. [Лит.]
- Реагирует с бромом и пентафторидом мышьяка в трифториде мышьяка при комнатной температуре с образованием гексафторарсената бромгептасеры(1+). [Лит.]
- Реагирует с пентафторидом сурьмы в трифториде мышьяка при комнатной температуре в присутствии следов галогенов с образованием бис(ундекафтордиантимоната) тетрасеры(2+). [Лит.]
- Сера воспламеняется во фторе и горит сине-фиолетовым пламенем, образуя гексафторид серы. Сера воспламеняется в жидком фторе. [Лит.1, Лит.2, Лит.3
 ]
]
S + 3F2 → SF6
- Реакция серы с хлором идет спокойно при комнатной температуре, но сильно ускоряется при нагревании, давая на первой стадии дихлорид дисеры S2Cl2. [Лит.1]
2S + Cl2 → S2Cl2
- Дихлорид октасеры можно получить реакцией серы и хлора в сероуглероде. [Лит.1
 ]
]
S8 + Cl2 → S8Cl2
- При слабом нагревании калий реагирует с серой с образованием сульфида калия. [Лит.1]
2K + S → K2S
- При нагревании серебро реагирует с серой давая сульфид серебра. [Лит.1
 , Лит.2]
, Лит.2]
2Ag + S → Ag2S
- Концентрированной серной кислотой сера окисляется примерно при 120°С до оксида серы(IV). [Лит.1]
2H2SO4 + S → 3SO2 + 2H2O
- Сера медленно реагирует с водородом при 120 С, значительно быстрее при 200 С, с образованием сероводорода. [Лит.1]
S + H2 → H2S
- Реакцией серы с жидким аммиаком получают тетранитрид тетрасеры. Для смещения равновесия этой обратимой реакции прибавляют иодид серебра осаждающий сульфид ионы в виде сульфида серебра. [Лит.1]
16NH3 + 10S → S4N4 + 6(NH4)2S
- Сульфид сурьмы(III) может быть получен сплавлением серы с сурьмой. [Лит.1]
2Sb + 3S → Sb2S3
- Оксид натрия реагирует с серой с образованием сульфида натрия и сульфата натрия. [Лит.1]
4Na2O + 4S → 3Na2S + Na2SO4
- При комнатной температуре монофторид хлора гладко реагирует с серой с образованием тетрафторида серы. [Лит.1]
S + 4ClF → SF4 + 2Cl2
- Кремний горит в парах серы при 100 С с образованием сульфида кремния. [Лит.1]
Si + 2S → SiS2
- Тетрасульфид калия получают сплавлением сульфида калия и серы. [Лит.1
 ]
]
K2S + 3S → K2S4
- Тетрасульфид натрия получают кипячением гидросульфида натрия с серой в абсолютном этаноле. [Лит.1
 ]
]
2NaSH + 3S → Na2S4 + H2S
- Нитрозилхлорид реагирует с серой около 100 С в растворе дихлорида дисеры c образованием оксида азота(II) и дихлорида дисеры. [Лит.1]
2NOCl + 2S → S2Cl2 + 2NO
- Сера реагирует с тетрахлорметаном при 200 С с образованием сероуглерода и дихлорида дисеры. Одновременно образуются следы тиофосгена, трихлорметилсульфенилхлорида и бис(трихлорметил)полисульфидов которые, очевидно, являются промежуточными продуктами реакции. В присутствии катализаторов (алюминий, железо, медь или их хлориды, наилучший - порошок железа) реакция идет при 120 С. [Лит.1]
6S + CCl4 → CS2 + 2S2Cl2
- При реакции серы с хлороформом и фторидом калия в сульфолане при 120-180 С образуется гексафтордиметилдисульфид. Выход 19,6%. [Лит.1, Лит.2
 ]
] - Ртуть реагирует с серой при комнатной температуре при растирании. [Лит.1]
- При высокой температуре никель реагирует с серой с образованием сульфида никеля(II). [Лит.1]
- Реакция серы с азидом натрия в гексаметилфосфаттриамиде дает гептасульфуримид. [Лит.1]
- Хлорит серебра взрывается при растирании с серой. [Лит.1]
- Пентафторид рутения фторирует серу при 0 С до гексафторида серы. [Лит.1]
Реакции, в которых вещество не участвует:
- Напрямую не реагирует с гелием, неоном, аргоном, криптоном, ксеноном, золотом, иодом, азотом и платиной, даже при нагревании. [Лит.]
- На холоду не реагирует с разбавленной азотной кислотой, соляной и серной кислотами. [Лит.]
- Чистый сухой кислород при комнатной температуре не реагирует с серой. [Лит.]
- Не реагирует с гексаном при 24-часовом нагревании в запаяной трубке при 210 С. [Лит.]
- Не реагирует с фторбензолом при 250 С. [Лит.]
- Золото не реагирует с кислородом и серой при любой температуре. [Лит.1]
- Оксид бора не реагирует с серой до 1000 С. [Лит.1]
- Азот не реагирует с серой. [Лит.1]
- Сера при температуре жидкого водорода не реагирует с твердым фтором. [Лит.1]
Периоды полураспада:
2716S = 21 мс (β+ (100%), β+2p (2%))
2816S = 125 мс (β+ (100%), β+p (20,7%))
2916S = 187 мс (β+ (100%), β+p (46,4%))
3016S = 1,178 с (β+ (100%))
3116S = 2,572 с (β+ (100%))
3216S = стабилен ( (содержание в природной смеси изотопов 95,02%))
3316S = стабилен ( (содержание в природной смеси изотопов 0,75%))
3416S = стабилен ( (содержание в природной смеси изотопов 4,21%))
3516S = 87,51 сут. (β- (100%))
3616S = стабилен ( (содержание в природной смеси изотопов 0,02%))
3716S = 5,05 мин (β- (100%))
3816S = 170,3 мин (β- (100%))
3916S = 11,5 с (β- (100%))
4016S = 8,8 с (β- (100%))
4116S = 1,99 с (β- (100%))
4216S = 1,013 с (β- (100%))
4316S = 260 мс (β- (100%), β-n (40%))
43m16S = 480 нс (изотопный переход (100%))
4416S = 123 мс (β- (100%), β-n (18%))
4516S = 82 мс (β- (100%), β-n (54%))
Давление паров (в мм рт.ст.):
0,1 (137°C)
1 (182°C)
10 (243°C)
100 (331°C)
Свойства растворов:
20% (вес.), растворитель - сероуглерод
Плотность (г/см3) = 1,3709 (15°)
Диэлектрическая проницаемость:
3,52 (118°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
10,94 (123°C)
7,09 (149,5°C)
7,19 (156,3°C)
77,2 (160,3°C)
500 (165°C)
1600 (184°C)
2150 (200°C)
1860 (220°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
0,708 (25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
31,9 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
22,7 (т)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
272,9 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
167,7 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
23,7 (г)Энтальпия кипения ΔHкип (кДж/моль):
9,2Некоторые нечисловые свойства вещества:
диамагнитное вещество
при трении электризуется отрицательно
Природные и антропогенные источники:
В атмосфере Солнца содержится 0,003 ат%. В земной коре содержится 0,0340% (по массе) серы, главным образом в виде соединений.
Вулканическая свободная сера широко распространена. Она встречается в горах, окамляющих Тихий океан, в Исландии и в Средиземноморье, особенно в Турции, Италии.
Большие эвапоритовые отложения элементарной серы в Польше были найдены только в 1953 году, но с тех пор они дали значительный вклад в экономику этой страны.
В виде соединений сера в природе существует в виде сероводорода, сульфидных и сульфатных минералов, а также в виде органических соединений в нефти.
В составе земной коры содержится 0,047% серы, в основном в виде соединений. В морской воде сера составляет 0,0885% от всех элементов. Всего известно около 200 минералов серы.
Самородная сера встречается в местах вулканической деятельности, где она осаждается в виде возгонов на стенках кратеров, в трещинах пород. Самородная сера также образуется при разложении сернистых соединений металлов, главным образом пирита. Месторождения самородной серы, образовавшейся осадочным путем, наиболее распространены в природе и имеют большое промышленное значение.
Симптомы острого отравления:
Человек. Сера практически не вызывает острых отравлений. Однако некоторые ее препараты, применяющиеся в медицинской практике, обладают выраженным токсическим действием. Использование мазей, содержащих серу, на большой поверхности кожи у грудных младенцев и маленьких детей может привести к интоксикации. Смертельная доза осажденной серы при приеме внутрь - около 12,0 г. При парентеральном введении сера вызывает резкую болезненность, общую пирогенную реакцию.
Симптомы хронического отравления:
Человек. У рабочих, занятых в производстве элементарной серы, в серных карьерах, на обогатительных фабриках, т. е. подвергающихся длительному воздействию серной пыли, аэрозоля элементарной серы и серусодержащих газов, наблюдаются профессиональные интоксикации. Жалобы на выделения из носа, жжение в глазах, слезотечение, светобоязнь, раздражительность, периодические головные боли, чаще в затылочной и лобно-теменных областях, головокружение, потливость, плохой сон и аппетит, диспептические расстройства, неприятные и болевые ощущения в области сердца. Много жалоб на тупые боли в правой подреберной области- периодического характера, усиливающиеся при физической нагрузке.
Объективно - гиперемия конъюнктивы, иногда с изъязвлениями, инъекция роговой оболочки, болезненность при пальпации в эпигастрии и правом подреберье, локальные симптомы со стороны желчного пузыря, увеличение печени, лейкоцитоз, моноцитоз, снижение уровня SH-групп, глутатиона и гемоглобина в периферической крови, угнетение пероксидазы крови, оживление сухожильных и периостальных рефлексов, нередко с расширенной рефлексогенной зоной, тремор пальцев вытянутых рук; красный стойкий местный дермографизм, иногда с наклонностью к разлитому, общий или локальный гипергидроз. При проведении ортостатической пробы учащение пульса, при проведении клиностатической пробы замедление пульса; чаще выявлялось изменение ортостатического рефлекса. Снижение кожной температуры на коже пальцев кистей. Нарастание частоты вегето-сосудистой дистонии и астено-вегетативного синдрома с увеличением стажа работы.
При обследовании в клинических условиях выявлен синдромокомплекс, включавший сочетанную патологию гепатогастральной, легочной, сердечно-сосудистой и нервной систем. Реэнцефалографически - отклонения в состоянии церебральной гемодинамики, в основном в виде изменений тонуса артериальных сосудов и асимметрии пульсового кровенаполнения полушарий мозга (изменение удавалось отметить еще в доклинический период). Нарушения нейроэндокринной регуляции регионарного кровообращения. Состояние подкожной васкуляризации по данным кожной термометрии изменено: асимметрия кожной температуры в симметричных точках, понижение в дистальных отделах рук. При капилляроскопии перикапиллярный отек, иногда в сочетании с капилляроскопической картиной спастико-атонического синдрома.
Кислотообразующая функция желудка изменена в сторону ровышения секреции соляной кислоты. При рентгенологическом и гастроскопическом исследовании желудка - изменение рельефа слизистых, в некоторых случаях язвенная болезнь с локализацией язвы в луковице двенадцатиперстной кишки. При дуоденальном зондировании в содержимом желчного пузыря увеличенное количество слизи, лейкоцитов, кристаллов холестерина и билирубината кальция.
У многих найдены изменения функционального состояния печени. Гипоальбуминемия, снижение альбумино-глобулинового индекса в сыворотке крови. Устойчивость белковых коллоидов по показателям пробы Вельтмана нарушена, активность трансаминаз повышена. На фоне явлений хронического гепатита либо гепатохолецистита нарушения внутрипеченочной гемодинамики, выявленные реогепатографически - изменения тонуса и эластичности средних и мелких артерий. Изменение гемодинамики в печени наступает раньше появления обменных расстройств.
При длительном вдыхании серной пыли возможны пневмокониозы. У значительного числа работающих находили преобладание дегенеративно-трофической формы амфодонтоза с ретракцией и атрофией десны, обнажением шеек и корней зубов и отложение зубного камня, катаральные и язвенные стоматиты. Все эти явления развивались на фоне выраженной анемии слизистой оболочки рта (Брилинский; Брилинский, Щепаняк; Кузьмина, Ивонина; Ивонина, Филатова; Чучмай и др.; Щепаняк и др.).
Местное действие. Человек. У рабочих серных рудников выявлены везикулезные высыпания на кистях рук и шелушение кожи, полностью исчезающее во время отпускного периода. Изредка порошкообразная С. может вызывать экземы.
Критическая температура (в °C):
1040Критическое давление (в МПа):
11,8Критическая плотность (в г/см3):
0,119Применение:
Используется в химической промышленности, главным образом для получения серной кислоты. В резиновой промышленности служит вулканизирующим агентом. Применяется в бумажном производстве для получения сульфат целлюлозы. Используется в производстве красителей, светящихся составов, пороха, спичек. В сельском хозействе используется для борьбы с болезными растений.
Применяется в расплавленном виде в серно-натриевых аккумуляторах.
Применяется в медицинской практике. Осажденная сера (серное молоко, Sulfur praecipitatum, Lac sulfuricus) используется только как наружное средство в дерматологии для лечения кожных заболеваний: себореи, сикоза, псориаза и др., входит в состав пасты Лассара, мази Вилькенсона и др. В качестве противоглистного средства применяют при энтеробиозе. Используется также как легкое слабительное (0,5-3 г на прием). Стерильный 1-2% раствор серы очищенной в персиковом масле (сульфозин) иногда применяют для пирогенной терапии при сифилисе. Для приема внутрь не следует заменять серу очищенную серой осажденной; последняя относительно быстро восстанавливается в кишечнике до сероводорода, что может привести к побочным явлениям.
История:
Известна с древнейших времен. Упоминания о сере имеются в многочисленных письменных источниках, начиная от описания легендарного разрушения огненным дождем Содома и Гоморры. Несомненно этот элемент был известен египтянам в XVI в. до н.э. и Гомер ссылается на использование серы для окуривания.
Черный порох, который произвел революцию в военном деле в XIII в. оставался единственным метательным веществом вплоть до середины XIX в., когда был изобретен пироксилин. Черный порох - смесь калиевой селитры, угля и серы в соотношении 75:15:10 по массе - был изобретен китайскими алхимиками более тысячи лет назад. Первый известный рецепт пороха обнаружен в китайских военных руководствах 1044 года, а его использование в пушках (бомбардах) известно по крайней мере с 1128 г.
В 1839 г. Чарльз Гудьир (США) открыл способ вулканизации натурального каучука нагреванием с серой.
В 1935 г. ренгеноструктурным анализом установлено циклическое строение молекулы S8.
Дополнительная информация::
Свойства серы как элемента. Электронная конфигурация атома 1s22s22p63s23p4. Относится к халькогенам. Наиболее характерные степени окисления -2, +4, +6.
При нагревании непосредственно соединяется со всеми элементами, кроме благородных газов, азота, теллура, иода, иридия, платины и золота.
Активная форма синглетной серы, генерируемая фотолизом оксид-сульфида углерода, реагирует с алканами с образованием меркаптанов.
Применение вещества:
- в производстве серной кислоты [Лит.]
- для вулканизации резины [Лит.]
Неверная или противоречивая информация:
- Голубое вещество состава S2O3, полученное из жидкого SO3 и серы, оказалось смесью солей катионов S42+ и S82+ с полисульфатными ионами. [Лит.]
- Сульфоксиловая H2SO2 и тиосернистая H2S2O2 кислоты и их соли в настоящее время считаются несуществующими. [Лит.]
Дополнительная информация:
При охлаждении до -50 С ромбическая сера обесцвечивается.
При добавлении 1% бензола к расплавленной сере при 120-200 С ее вязкость уменьшается в 200 раз. Иод и аммиак тоже уменьшают вязкость серы.
При давлении выше 85 ГПа и температуре 25 С сера переходит в металлическую фазу с орторомбической структурой, которая при 162 ГПа переходит в ромбоэдрическую форму.
Источники информации:
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1442-1455
- Вредные химические вещества: Неорганические соединения элементов V-VIII групп. Справочник. - Л., 1989. - С. 170-192
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 5-27, 34, 57
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 51
- Иванова М.А., Кононова М.А. Химический демонстрационный эксперимент. - М.: Высшая школа, 1969. - С. 31, 36
- Малин К.М., Боресков Г.К., Пейсахов И.Л., Слинько М.Г., Смыслов Н.И., Второв М.Н., Аркин Н.Л. Технология серной кислоты и серы. - М.-Л.: ГНТИХЛ, 1941. - С. 14-18
- Машковский М.Д. Лекарственные средства. - 12-е изд., Т. 2. - М.: Медицина, 1998. - С. 372
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 311-312, 319-323
- Природная сера. - М.: Химия, 1972
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 96
- Реакции серы с органическими соединениями. - Новосибирск: Наука, 1979
- Реми Г. Курс неорганической химии. - Т.1. - М., 1963. - С. 750-756
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 601-616
- Справочник сернокислотчика. - Под ред. Малина К.М. - М.: Химия, 1971. - С. 38-50
- Химическая энциклопедия. - Т. 4. - М.: Советская энциклопедия, 1995. - С. 319-321
- Энциклопедия для детей. - Т.17: Химия. - М.: Аванта+, 2004. - С. 236
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер