Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
тетрасеры тетранитрид
Синонимы и иностранные названия:
sulfur nitride (англ.)
tetrasulfur tetranitride (англ.)
сера азотистая (рус.)
тетраазота тетрасульфид (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
тетранитрид тетрасеры Тип вещества:
неорганическое
Внешний вид:
оранжево-желт. кристаллы
Внешний вид при разных температурах:
светло-желт. кристаллы (-30°C)
оранжев. кристаллы (20°C)
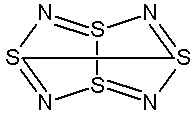
темно-красн. кристаллы (100°C)Кристаллические модификации, структура молекулы, цвет растворов и паров:
Длины связей в молекуле одинаковы, что указывает на делокализацию электронов.
Брутто-формула (по системе Хилла для органических веществ):
N4S4Формула в виде текста:
N4S4Молекулярная масса (в а.е.м.): 184,29
Температура плавления (в °C):
179Температура разложения (в °C):
180Растворимость (в г/100 г растворителя или характеристика):
бензол: 0,258 (0°C) [Лит.]
бензол: 0,716 (20°C) [Лит.]
бензол: 1,94 (60°C) [Лит.]
вода: не растворим [Лит.]
сероуглерод: 0,294 (0°C) [Лит.]
сероуглерод: 0,745 (20°C) [Лит.]
сероуглерод: 1,34 (40°C) [Лит.]
этанол: 0,082 (0°C) [Лит.]
этанол: 0,133 (20°C) [Лит.]
этанол: 0,208 (50°C) [Лит.]
Энергии, длины и углы связей молекул вещества:
Длина связи (пм): 258 (S(1)-S(5))
Длина связи (пм): 162 (S-N)
Угол связи (°): 105 (N-S-N)
Угол связи (°): 113 (S-N-S)
Некоторые числовые свойства вещества:
Год открытия: 1835 (Грегори У.)
Год установления структуры: 1944
Способы получения:
- Реакция дихлорида дисеры или хлорида серы(II) с аммиаком в тетрахлорметане или бензоле. [Лит.]
6S2Cl2 + 16NH3 → S4N4 + 12NH4Cl + 8S
- Нагревание смеси дихлорида дисеры с хлоридом аммония до 160 С дает тетранитрид тетрасеры. Выход 26%. [Лит.1]
6S2Cl2 + 4NH4Cl → S4N4 + 8S + 16HCl
- При -95 С тетрафторид серы реагирует с аммиаком с образованием тетранитрида тетрасеры, фторида аммония и азота Выход 70%. [Лит.1]
12SF4 + 64NH3 → 3S4N4 + 48NH4F + 2N2
- Реакцией серы с жидким аммиаком получают тетранитрид тетрасеры. Для смещения равновесия этой обратимой реакции прибавляют иодид серебра осаждающий сульфид ионы в виде сульфида серебра. [Лит.1]
16NH3 + 10S → S4N4 + 6(NH4)2S
Реакции вещества:
- При нагревании выше температры плавления или при ударе со взрывом разлагается на азот и серу. [Лит.]
- Очень медленно разлагается водой с образованием тритионата аммония, тиосульфата аммония и аммиака. [Лит.]
- Иодоводородной кислотой восстанавливается до аммиака и сероводорода. [Лит.]
- Разлагается разбавленными щелочами до тиосульфата, тритионата и аммиака. [Лит.]
- Разлагается концентрированными щелочами до тиосульфата, сульфита и аммиака. [Лит.]
- Реагирует с пероксидисульфурилдифторидом при 65 С с образованием бис(фторсульфонил)-тетранитрида тетрасеры и бис(фторсульфонил)амида серы(II). [Лит.]
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
460 (т) [Лит.]
Некоторые нечисловые свойства вещества:
обладает термохромными свойствами
История:
В неочищенном виде получен У. Грегори в 1835 г., стереохимия и тетрамерная природа соединения была установлена в 1851 г., циклическое строение - в 1944 г.
Дополнительная информация::
Дихлоридом олова в кипящей смеси этанола и бензола восстанавливается до S4(NH)4. С S2Cl2 дает (S4N3)Cl, с хлором в тетрахлорметане - N3(SCl)3.
Источники информации:
- Advances in Inorganic Chemistry and Radiochemistry. - 1972. - Vol. 15. - С. 377-392
- Bell C.F. Syntheses and Physical Studies of Inorganic Compounds. - Pergamon Press, 1972. - С. 113-123
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 4-93
- Chivers T. A guide to chalcogen-nitrogen chemistry. - 2005. - С. 85-88
- Housecroft C.E., Sharpe A.G. Inorganic Chemistry. - 2ed. - 2005. - С. 462-464
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1455
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 72-78
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 396
- Самсонов Г.В. Нитриды. – Киев: Наукова думка, 1969. - С. 300
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 981-982
- Турова Н.Я. Неорганическая химия в таблицах. - М., 1997. - С. 21
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер