Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
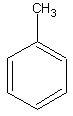
метилбензол
Синонимы и иностранные названия:
methylbenzene (англ.)
toluene (англ.)
толуол (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C7H8Формула в виде текста:
C6H5CH3Молекулярная масса (в а.е.м.): 92,138
CAS №: 108-88-3
Температура плавления (в °C):
-95Температура кипения (в °C):
110,626Температурные константы смесей (содержание в весовых процентах):
63,5 °C (температура кипения азеотропа, давление 1 атм) метанол 72,2% метилбензол 27,8%
74,4 °C (температура кипения азеотропа, давление 1 атм) вода 12% метилбензол 51% этанол 37%
76,3 °C (температура кипения азеотропа, давление 1 атм) вода 13,1% метилбензол 48,7% пропан-2-ол 38,2%
76,7 °C (температура кипения азеотропа, давление 1 атм) метилбензол 32% этанол 68%
105,5 °C (температура кипения азеотропа, давление 1 атм) бутан-1-ол 27,5% метилбензол 72,5%
109,2 °C (температура кипения азеотропа, давление 1 атм) 1-хлорпропан-2-он 28,5% метилбензол 71,5%
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: мало растворим [Лит.]
вода: 0,057 (16°C) [Лит.]
вода: 0,063 (25°C) [Лит.]
диэтиленгликоль: 20,7 (25°C) [Лит.]
пропиленгликоль: 14 (25°C) [Лит.]
сульфолан: смешивается [Лит.]
фтороводород: 1,02 (-20°C) [Лит.]
фтороводород: 1,56 (0°C) [Лит.]
фтороводород: 2,43 (15°C) [Лит.]
этанол 92%: 733 (15°C) [Лит.]
этиленгликоль: 3,1 (25°C) [Лит.]
Плотность:
0,96 (-183°C, г/см3, состояние вещества - кристаллы)
0,86694 (20°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Октановое число: 115
Порог восприятия запаха в воздухе (мг/л): 0,0094
Скорость выгорания со свободной поверхности (кг/(м2·ч)): 138,29
Нормативные документы, связанные с веществом:
- ГОСТ Р ИСО № 16017-1-2007 "Воздух атмосферный, рабочей зоны и замкнутых помещений. Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 1. Отбор проб методом прокачки"
- Гигиенические нормативы (ГН) № 2.1.5.2280-07 "Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. Дополнения и изменения №1" (Описание документа: ПДК в питьевой воде; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,024 (органолептический, меняет запах воды)
- Гигиенические нормативы (ГН) № 2.1.7.2041-06 "Предельно допустимые концентрации (ПДК) химических веществ в почве" (Описание документа: ПДК в почве; Документ устарел.)
- предельно допустимая концентрация (мг/кг) в почве = 0,3
- МУК № 4.1.598-96 "Методические указания по газохроматографическому определению ароматических, серусодержащих, галогенсодержащих веществ, метанола, ацетона и ацетонитрила в атмосферном воздухе"
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
- Методические рекомендации (МР) № 01.023-07 "Газохроматографическое определение гексана, гептана, бензола, толуола, этилбензола, м-, о-, п-ксилолов, изопропилбензола, н-пропилбензола, стирола, α-метилстирола, бензальдегида в воздухе из замкнутого объема, содержащего материалы различного состава"
- Методические рекомендации (МР) № 01.024-07 "Газохроматографическое определение гексана, гептана, ацетальдегида, ацетона, метилацетата, этилацетата, метанола, изо-пропанола, акрилонитрила, н-пропанола, н-пропилацетата, бутилацетата, изо-бутанола, н-бутанола, бензола, толуола, этилбензола, м-, о- и п-ксилолов, изопропилбензола, стирола, альфа-метилстирола в водных вытяжках из материалов различного состава"
- ПНД Ф № 14.1:2:4.57-96 "Методика выполнения измерений массовых концентраций бензола, толуола, этилбензола, о-ксилола, м-ксилола, п-ксилола и стирола в пробах питьевых, природных и сточных вод методом газовой хроматографии" (Описание документа: ГЖХ анализ вод парофазным методом.)
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица III, с концентрацией 70% и более)
Используется для синтеза веществ:
1,1-ди(4-метилфенил)этан
1-бром-4-метилбензол
бензойная кислота
Реакции вещества:
- Реагирует с тетрагидратом пербората натрия в присутствии трифторметансульфокислоты с образованием смеси метилфенолов (соотношение о/м/п = 65/9/26). (выход 66%) [Лит.]
- Реагирует с формальдегидом и хлороводородом с образованием 1-метил-4-(хлорметил)бензола. [Лит.]
- Нитруется 69% азотной кислотой в присутствии трифлата иттербия при кипячении в 1,2-дихлорэтане в течение 12 часов до суммы мононитрованных изомеров (о:м:п = 52:7:41). (выход 95%) [Лит.]
- Реагирует с паральдегидом во фтористоводородной кислоте при 0-5 С в течение 1-3 часов с образованием 1,1-дитолилэтана. [Лит.]
- Реагирует с азотистоводородной кислотой в присутствии хлорида алюминия с образованием смеси толуидинов (соотношение о/м/п = 49/14/37). (выход 65%) [Лит.]
- Реагирует с монохлорамином в присутствии хлорида алюминия в дихлорметане при -35 С с образованием смеси м-толуидина (выход 13%), о-хлортолуола (выход 40%) и п-хлортолуола (выход 27%). [Лит.]
- Реагирует с трихлоридом азота в присутствии хлорида алюминия в дихлорметане при -35 С с образованием смеси м-толуидина (выход 39-43%), о-хлортолуола (выход 34%) и п-хлортолуола (выход 24%). [Лит.]
- Ацетилируется ацетилгексафторантимонатом в нитрометане с образованием 4-метилацетофенона. (выход 96%) [Лит.]
- Окисляется диизопропилпероксидикарбонатом в присутствии хлорида алюминия с образованием смеси метилфенолов с соотношением орто:мета:пара = 34:11:55. (выход 50%) [Лит.]
- Реагирует с диизопропилпероксидикарбонатом в присутствии хлорида меди(II) с образованием смеси толилизопропилкарбонатов с преобладанием орто-изомера. (выход 78%) [Лит.]
- Хлорируется трет-бутилгипохлоритом до бензилхлорида. (выход 62%) [Лит.]
- Восстанавливается натрием в жидком аммиаке в присутствии этанола до 1-метилциклогекса-1,4-диена. (выход 50%) [Лит.]
- Иодируется смесью иода с азотной кислотой при 100 °С с образованием 4-иодтолуола. (выход 60%) [Лит.]
- Ацетилируется уксусным ангидридом в присутствии хлорида алюминия с образованием 4-метилацетофенона. (выход 85%) [Лит.]
- Хлорируется на свету или в присутствии перекисей по метильной группе с образованием бензилхлорида, затем бензальхлорида и бензилтрихлорида. [Лит.]
- Бромируется бромом в присутствии бромида железа(III) с образованием смеси 4- и 2-бромтолуолов (65:35). [Лит.]
- Хлорируется хлором в присутствии хлорида железа(III) с образованием смеси 4- и 2-хлортолуолов (55:45). [Лит.]
- Окисляется при кипячении с перманганатом калия в щелочной среде до соли бензойной кислоты. Добавление 18-краун-6 или бромида тетрабутиламмония повышает выход. [Лит.]
- Толуол гидрируется водородом над никелевым катализатором с образованием метилциклогексана. Выход 86%. [Лит.1
 , Лит.2
, Лит.2 ]
]
C6H5CH3 + 3H2 → C6H11CH3
- Реакцией толуола с уротропином и трифторуксусной кислотой была получена смесь 4-метилбензальдегида (выход 50%) и 2-метилбензальдегида (выход 11%). [Лит.1]
- Сухие бензол и толуол слабо реагируют с пентафторидом рутения. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4969 (20°C)
Давление паров (в мм рт.ст.):
0,0075 (-78,1°C)
0,075 (-57,1°C)
0,75 (-31,3°C)
1 (-26,1°C)
7,5 (1,5°C)
10 (6,4°C)
14 (14,5°C)
40 (31,8°C)
75 (45,2°C)
100 (51,9°C)
400 (89,5°C)
750 (110,1°C)
Показатели диссоциации:
pKBH+ (1) = -6,3 (0°C, фтороводород)
pKa (1) = 35 (20°C, вода, CH3 группа)
Индекс удерживания для газовой хроматографии:
761,7 (фаза колонки - DB-5, со скоростью подъема температуры 6 К/мин)
Диэлектрическая проницаемость:
2,379 (25°C)
Логарифм давления насыщенного пара (в мм рт.ст.): lg p = 8,330 - 2047,3/T (при T = 181-258 K)
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
12,4 (ж) [Лит.]
50,5 (г) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
157,3 (ж) [Лит.]
Летальная доза (ЛД50, в мг/кг):
7000 (белые крысы, перорально)
Аналитические реакции вещества:
- реагент: перманганат калия щелочной раствор; результат реакции: при небольшом нагревании исчезает окраска перманганата и выпадает осадок диоксида марганца
Источники информации:
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 542-543
- Smallwood I.M. Handbook of organic solvent properties. - 1996. - С. 39-41
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 390-391
- Абрамзон А.А. Поверхностно-активные вещества: Свойства и применение. - Л.: Химия, 1981. - С. 79
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров. - М.: МЦФЭР, 2000. - С. 147
- Воскресенский П.И., Каверина А.А., Парменов К.Я., Цветков Л.А., Эпштейн Д.А. Справочник по химии. - 4 изд. - М.: Просвещение, 1978. - С. 200
- Гордон А., Форд Р. Спутник химика. - М.: Мир, 1976. - С. 76
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 229
- Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978. - С. 622-623
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 183
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 476
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1224
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер