Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
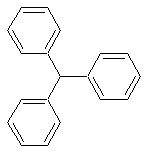
трифенилметан
Синонимы и иностранные названия:
triphenylmethane (англ.)
тритан (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. кристаллыКристаллические модификации, структура молекулы, цвет растворов и паров:
Существует в 2 кристаллических формах - лабильной (т.пл. 81 С) и стабильной (т .пл. 94 С).
Брутто-формула (по системе Хилла для органических веществ):
C19H16Формула в виде текста:
(C6H5)3CHМолекулярная масса (в а.е.м.): 244,32
Температура плавления (в °C):
94Температура кипения (в °C):
359Растворимость (в г/100 г растворителя или характеристика):
анилин: 5,7 (23°C) [Лит.]
бензол: 4,06 (4°C) [Лит.]
бензол: 7,24 (19,4°C) [Лит.]
бензол: 8,95 (23,1°C) [Лит.]
вода: не растворим [Лит.]
гексан: 3,6 (0°C) [Лит.]
гексан: 9,05 (20°C) [Лит.]
диоксид серы: 19 (20°C) [Лит.]
диэтиловый эфир: легко растворим [Лит.]
пиридин: 85,9 (22,8°C) [Лит.]
пиррол: 32,1 (24,6°C) [Лит.]
сероуглерод: 0,99 (-113,5°C) [Лит.]
сероуглерод: 3,52 (-60°C) [Лит.]
сероуглерод: 34,77 (0°C) [Лит.]
сероуглерод: 76 (20°C) [Лит.]
тиофен: 35,1 (25,7°C) [Лит.]
хлороформ: 40,65 (0°C) [Лит.]
хлороформ: 70,9 (20°C) [Лит.]
хлороформ: 176,2 (50°C) [Лит.]
этанол: мало растворим [Лит.]
Плотность:
1,014 (99°C, относительно воды при 4°C, состояние вещества - жидкость)
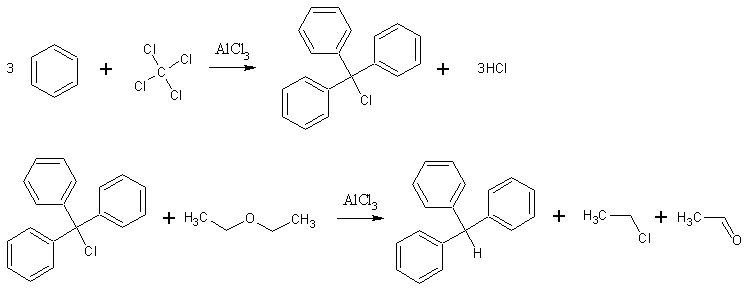
Метод получения 1:
Источник информации: Голодников Г.В. Практические работы по органическому синтезу. - Л.: ИЛУ, 1966 стр. 164
Работу проводить в вытяжном шкафу!
В круглодонную колбу емкостью 200 мл, снабженную обратным холодильником с хлоркальциевой трубкой, последовательно вносят 29 г сухого бензола, 12 г сухого четыреххлористого углерода и 10 г безводного хлористого алюминия в виде мелких кусков. Колбу немедленно погружают в ледяную воду так, чтобы уровень воды был лишь на 5 см ниже отверстия колбы, и оставляют в воде на 24 ч, причем за это время температуре воды дают подняться до уровня комнатной.
(Если реакционную смесь выдерживать в холодной воде меньшее количество часов или те же 24 ч, но при более низкой температуре, то выход падает.) Затем при взбалтывании прибавляют через холодильник небольшими порциями в течение 20 мин 11 г абсолютного диэтилового эфира и смесь опять оставляют стоять.
Через сутки реакционную массу выливают в смесь 65 г льда с 2,5 мл концентрированной соляной кислоты, находящуюся в колбе емкостью 500 мл; туда же прибавляют 100 мл бензола, после чего колбу соединяют с обратным холодильником и кипятят смесь на водяной бане 5—10 мин. Когда масса охладится до 40—50° С, бензольный слой отделяют и промывают 70 мл теплой воды, содержащей 2,5 мл концентрированной соляной кислоты. Промытый раствор переносят в колбу, отгоняют бензол при атмосферном давлении и остаток перегоняют в вакууме из колбы емкостью 50 мл, собирая фракцию 190—215°С (10 мм рт. ст.). (В колбе остается 2—4 г темной густой массы.)
Таким образом, получается 13—16 г не вполне чистого трифенилметана, затвердевающего при охлаждении. Его перекристаллизовывают из 55—65 мл кипящего этилового спирта.
(Можно перекристаллизовать из 160—170 мл метилового спирта, для чего 3 вес. части трифенилметана растворяют в 1 вес. части теплого бензола. Из такого раствора трифенилметан кристаллизуется с одной молекулой бензола, которая теряется при хранении вещества на воздухе или при перекристаллизации его из спирта.)
По охлаждении выпавшие бесцветные иглы отсасывают, два раза промывают спиртом порциями по 3 мл и сушат на воздухе. Спиртовый маточный раствор упаривают и остаток перегоняют в вакууме, собирая фракцию 190—200°С (10 мм рт. ст.), которую перекристаллизовывают из спирта, как указано выше. Таким образом, получают еще ~ 1 г чистого продукта.
Общий выход — 13—15 г (65—75%) чистого трифенилметана, резко плавящегося при 92° С.
Способы получения:
- Расщепление 1,1,1,2-тетрафенилэтанона трет-бутилатом калия в диметилсульфоксиде при 25 С. (выход 97%) [Лит.]
Реакции вещества:
- Окисляется кислородом в диметилсульфоксиде в присутствии трет-бутанола и трет-бутилата калия в трифенилметанол. [Лит.]
Показатель преломления (для D-линии натрия):
1,5839 (99°C)
Показатели диссоциации:
pKa (1) = 33 (25°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-162,19 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
312,57 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
295,4 (т)Энтальпия плавления ΔHпл (кДж/моль):
21,57Применение:
Стабилизатор полимеров и топлив.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 3-540
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 792-794
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 976, 1315, 1371, 1445-1446, 1462, 1471
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 7
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер