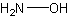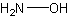Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
гидроксиламин
Синонимы и иностранные названия:
hydroxylamine (англ.)
Тип вещества:
неорганическое
Внешний вид:
бесцветн. ромбические кристаллыБрутто-формула (по системе Хилла для органических веществ):
H3NOФормула в виде текста:
NH2OHМолекулярная масса (в а.е.м.): 33,0298
Температура плавления (в °C):
32Температура разложения (в °C):
100Растворимость (в г/100 г растворителя или характеристика):
ацетон: растворим [Лит.]
бензол: мало растворим [Лит.]
вода: смешивается [Лит.]
диэтиловый эфир: 1,2 (35,6°C) [Лит.]
метанол: 53,85 (5°C) [Лит.]
сероуглерод: мало растворим [Лит.]
хлороформ: мало растворим [Лит.]
этанол абсолютный: 17,65 (15°C) [Лит.]
этилацетат: 1,6 (77,15°C) [Лит.]
Плотность:
1,216 (10°C, г/см3, состояние вещества - кристаллы)
1,204 (20°C, г/см3, состояние вещества - кристаллы)
Метод получения 1:
Источник информации: Неорганические синтезы. - Сб. 1. - М.: ИИЛ, 1951 стр. 88-891-литровую круглодонную колбу, снабженную механической мешалкой, закрывают каучуковой пробкой. Желательно, чтобы затвор был герметичным, но нет необходимости использовать ртутный затвор. В пробке должна иметься стеклянная трубка с капилляром, сообщающимся с атмосферой, служащая выходным отверстием, и трубка для подачи раствора бутилата из капельной воронки. Эту трубку нужно изогнуть так, чтобы раствор можно было подавать в ту часть колбы, где происходит наиболее интенсивное перемешивание. Нижняя часть капельной воронки снабжена паровым обогревателем, чтобы предотвратить затвердевание бутилата натрия. Легко сделать змеевиковый обогреватель, обернув свинцовую трубку диаметром 0,4 —0,5 см вокруг капельной воронки. Раствор бутилата натрия готовят в колбе с обратным холодильником нагреванием 23,5 г натрия с 300 мл продажного перегнанного бутилового спирта (т. кип. 115 — 117,5 С). Полученный раствор должен быть достаточно бесцветным, чтобы не маскировать цвет индикатора. Коричневая окраска — следствие окисления кислородом воздуха. Попадание воздуха через холодильник можно предотвратить пропусканием водорода, выделяющегося во время реакции в реакционную колбу. Для этого используют небольшую трубку в форме перевернутой буквы U. Эту водородную ловушку соединяют с трубкой, наполненной натронной известью для поглощения влаги и углекислоты. Натрий растворяется довольно медленно, если не поддерживать повышенную температуру. На бурую окраску, которая появляется в теплом щелочном растворе при быстром переливании его из колбы в капельную воронку, можно не обращать внимания. В колбу насыпают 70 г (1,0 моль) хорошо высушенного и тонко размельченного солянокислого гидроксиламина и 0,01 — 0,02 г твердого фенолфталеина. Добавляют 100 мл бутилового спирта, и после 10-минутного предварительного перемешивания вводят раствор бутилата с такой скоростью, чтобы индикатор не давал розового окрашивания. Приблизительно через 2,5 часа реакция уже заканчивается. Чтобы уничтожить розовую окраску, в колбу вводят небольшое количество солянокислого гидроксиламина, и перемешивание продолжают до тех пор, пока раствор не станет бесцветным.
Хлористый натрий собирают на фильтре и отжимают досуха. Его промывают несколькими миллилитрами бутилового спирта и затем четырьмя порциями абсолютного эфира объемом по 15 мл. Добавление эфира понижает растворимость гидроксиламина в фильтрате, который помещают в плотно закрытую колбу и охлаждают до -10 С.
Гидроксиламин начинает кристаллизоваться уже при 0 С в виде больших белых чешуек. Охлаждение ниже -10 С производят для увеличения выхода.
Полученные таким образом кристаллы быстро собирают на фильтр, промывают холодным эфиром и помещают в эксикатор на 15 мин. для удаления растворителя. Если гидроксиламин используется не сразу, то его нужно поместить в закрытой трубке в лед.
Выход 21,0 г (63,5% от теоретического).
Гидроксиламин, оставшийся в фильтрате, можно извлечь в виде солянокислого гидроксиламина. Для этой цели добавляют концентрированную соляную кислоту до тех пор, пока прибавление соляной кислоты не перестанет вызывать осаждения. Осадок отфильтровывают и высушивают. Выход — 15 г. Фильтрат состоит в основном из бутилового спирта и содержит избыток кислоты, воду и некоторое количество неосажденного солянокислого гидроксиламина. Для регенерации бутилового спирта фильтрат обрабатывают сухим поташом и перегоняют.
Гидроксиламин — чрезвычайно неустойчивое соединение, которое, будучи абсолютно чистым, плавится при 33 С и кипит при 58 С (22 мм рт.ст.). При высоких температурах сильно взрывает. Быстро разлагается при комнатной температуре, особенно в присутствии влаги и углекислоты воздуха. Хорошо растворим в воде, жидком аммиаке и метиловом спирте. Его растворимость в высших спиртах уменьшается с увеличением молекулярного веса последних.
Способы получения:
- Гидролиз нитроэтана сильными кислотами, с последующей обработкой полученной соли гидроксиламина щелочами. [Лит.]
- Гидроксиламин может быть получен реакцией бутилата натрия с гидрохлоридом гидроксиламина. [Лит.1
 , Лит.2
, Лит.2 ]
]
NH2OH * HCl + CH3CH2CH2CH2ONa → NH2OH + CH3CH2CH2CH2OH + NaCl
Реакции вещества:
- При нагревании до 130 С разлагается со взрывом. [Лит.]
- Воспламеняется в потоке хлора. [Лит.]
- Восстанавливает сульфат меди(II). [Лит.]
- Восстанавливает аммиачный раствор нитрата серебра. [Лит.]
- При нагревании на воздухе взрывается между 60 и 100 С или при контакте с пламенем. [Лит.]
- Реагирует с кальцием при 5 С с образованием очень взрывчатой соли. [Лит.]
- В эфирном растворе реагирует с натрием с образованием очень взрывчатой соли. [Лит.]
- Окисляется иодом до оксида азота(I). [Лит.]
- Окисляется хлоридом железа(III) до оксида азота(I). [Лит.]
- Восстанавливается сульфатом железа(II) в серной кислоте до сульфата аммония. [Лит.]
- Гипонитрит натрия получают реакцией гидроксиламина с этилнитритом и этоксидом натрия в этаноле. Выход 13%. [Лит.1, Лит.2, Лит.3
 ]
]
NH2OH + C2H5ONO + 2C2H5ONa → Na2N2O2 + 3C2H5OH
- Глиоксим образуется при реакции гликсаля с гидроксиламином. [Лит.1]
(CHO)2 + 2NH2OH → (CH=NOH)2 + 2H2O
- Циановодород реагирует со спиртовым раствором гидроксиламина при комнатной температуре с образованием формамидоксима. [Лит.1]
HCN + NH2OH → HC(NH2)=NOH
- Глиоксим образуется при реакции 1,2-дихлор-2-этоксиэтана с гидроксиламином. Выход 40%. [Лит.1]
- Сульфаминовая кислота может быть получена реакцией диоксида серы с гидроксиламином в водном растворе или в присутствии пиридина. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4400 (23,5°C, для жидкости)
Давление паров (в мм рт.ст.):
22 (58°C)
Стандартный электродный потенциал:
N2 + 4H2O + 2e- → 2NH2OH + 2OH-, E = -3,04 (вода, 25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-115 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-17,4 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
66,5 (т)Энтальпия плавления ΔHпл (кДж/моль):
16,5Энтальпия кипения ΔHкип (кДж/моль):
47,7Источники информации:
- Encyclopedia of explosives and related items. - Vol. 7. - New Jersey, 1975. - С. H243 - H245
- Inorganic Syntheses. - Vol. 1. - New York and London, 1939. - С. 87-89
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1028
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 97-98
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 402
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 51
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 912
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 14-15
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 559
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер