Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
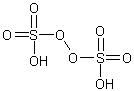
пероксидисерная кислота
Синонимы и иностранные названия:
peroxydisulfuric acid (англ.)
надсерная кислота (рус.)
Тип вещества:
неорганическое
Внешний вид:
бесцветн. твердое веществоБрутто-формула (по системе Хилла для органических веществ):
H2O8S2Формула в виде текста:
H2S2O8Молекулярная масса (в а.е.м.): 194,141
Температура плавления (в °C):
65Температура разложения (в °C):
65Растворимость (в г/100 г растворителя или характеристика):
диэтиловый эфир: плохо растворим [Лит.]
серная кислота: растворим [Лит.]
этанол: растворим [Лит.]
Метод получения 1:
Источник информации: Руководство по препаративной неорганической химии. - Под ред. Брауера Г. - М.: ИИЛ, 1956 стр. 200-201
2HSO3Cl + H2O2 → H2S2O8 + 2HCl
Чистую хлорсульфоновую кислоту медленно обрабатывают при сильном охлаждении необходимым для реакции количеством 100%-ной перекиси водорода. Реакция протекает с выделением хлороводорода, продолжающимся еще в течение долгого времени после прибавления всей перекиси водорода. По прекращении выделения газа смесь постепенно нагревают и откачивают растворенный и выделяющийся хлороводород водостуйным насосом. Жидкость оставляют стоять в закрытой колбе; в большинстве случаев через некоторое время она медленно затвердевает при комнатной температуре. Охлаждением и внесением затравки можно ускорить кристаллизацию. Во время кристаллизации выделение хлороводорода снова становится энергичным, так как в маточном растворе накапливаются хлорсульфоновая и пероксомоносерные кислоты. Приблизительно через 12 часов твердую кислоту быстро отфильтровывают через стеклянную пористую пластинку. Степень чистоты 92-98%.
Выход 60% от теоретического. Из маточного раствора можно путем сильного охлаждения получить еще некоторое количество неочищеной фракции.
Свойства. Бесцветное мелкокристаллическое вещество с запахом озона. В высшей степени гигроскопична. В чистом виде в течение многих недель устойчива лишь с незначительной потерей активного кислорода; в неочищенном виде значительно менее устойчива. Сильный окислитель. Растворяется в воде с шипением, при этом в значительной степени происходит реакция с образованием кислоты Каро и перекиси водорода. Без разложения растворяется в спирте, плохо растворяется в эфире.
Способы получения:
- Пероксидисерную кислоту получают электролизом растворов чистой серной кислоты плотностью 1,285 г/см3 (около 40%) на гладких платиновых электродах. Выход 70%. [Лит.1, Лит.2, Лит.3, Лит.4]
2H2SO4 → H2S2O8 + H2
Реакции вещества:
- Ванадий окисляется до высшей степени окисления хлорной, хлорноватой, бромноватой, иодноватой и пероксодисерной кислотами. [Лит.1]
Дополнительная информация::
Сильный, но медленный окислитель. Обычно используются соли серебра как катализаторы окисления. Окисляет тиосульфат до тетратионата.
Источники информации:
- Zeitschrift fur anorganische Chemie. - 1911. - Band 73, №1. - С. 350-354 [DOI: 10.1002/zaac.19120730120]
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 65
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. - С. 190-191
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 342
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер