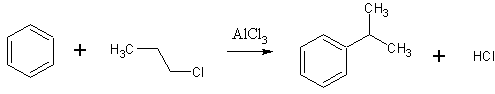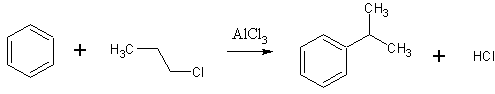Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
пропан-2-илбензол
Синонимы и иностранные названия:
2-phenylpropane (англ.)
cumene (англ.)
isopropylbenzene (англ.)
изопропилбензол (рус.)
кумол (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C9H12Формула в виде текста:
C6H5CH(CH3)2Молекулярная масса (в а.е.м.): 120,192
CAS №: 98-82-8
Температура плавления (в °C):
-96,028Температура кипения (в °C):
152,392Растворимость (в г/100 г растворителя или характеристика):
ацетон: смешивается [Лит.]
бензол: растворим [Лит.]
вода: 0,005 (25°C) [Лит.]
вода: 0,01473 (75,04°C) [Лит.]
диэтиловый эфир: растворим [Лит.]
петролейный эфир: смешивается [Лит.]
тетрахлорметан: смешивается [Лит.]
этанол: растворим [Лит.]
Плотность:
0,8702 (10°C, г/см3, состояние вещества - жидкость)
0,8618 (20°C, г/см3, состояние вещества - жидкость)
0,8575 (25°C, г/см3, состояние вещества - жидкость)
0,85751 (25°C, относительно воды при 4°C, состояние вещества - жидкость)
0,8534 (30°C, г/см3, состояние вещества - жидкость)
0,845 (40°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Октановое число: 105
Порог восприятия запаха в воздухе (мг/л): 2,5E-5-0,0001
Нормативные документы, связанные с веществом:
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
- Методические рекомендации (МР) № 01.023-07 "Газохроматографическое определение гексана, гептана, бензола, толуола, этилбензола, м-, о-, п-ксилолов, изопропилбензола, н-пропилбензола, стирола, α-метилстирола, бензальдегида в воздухе из замкнутого объема, содержащего материалы различного состава"
- Методические рекомендации (МР) № 01.024-07 "Газохроматографическое определение гексана, гептана, ацетальдегида, ацетона, метилацетата, этилацетата, метанола, изо-пропанола, акрилонитрила, н-пропанола, н-пропилацетата, бутилацетата, изо-бутанола, н-бутанола, бензола, толуола, этилбензола, м-, о- и п-ксилолов, изопропилбензола, стирола, альфа-метилстирола в водных вытяжках из материалов различного состава"
Метод получения 1:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 157-158
Круглодонную колбу соединяют при помощи двурогого форштоса с капельной воронкой и обратным холодильником. Капельную воронку и холодильник закрывают хлоркальциевыми трубками. К наружному концу хлоркальциевой трубки, закрывающей холодильник, присоединяют стеклянную трубку, опущенную в колбу или стакан с водой для поглощения хлороводорода. Конец трубки должен находиться на расстоянии 1 см от поверхности воды. В колбу вносят 80 мл сухого бензола, 2 г безводного измельченного хлорида алюминия и нагревают, содержимое на водяной бане до 80°С (термометр в бане). Все операции с безводным хлоридом алюминия необходимо проводить по возможности быстро, так как он чрезвычайно гигроскопичен, с водой реагирует со взрывом!
В капельную воронку наливают 10 мл хлористого пропила, 20 мл бензола, перемешивают и по каплям вносят этот раствор в нагретую реакционную массу. После прибавления всего количества хлористого пропила колбу выдерживают в бане при 80°С до прекращения выделения хлороводорода (контроль по смоченной в воде индикаторной бумаге). Затем реакционную смесь выливают в стакан со льдом и 10%-ным раствором соляной кислоты, переносят в делительную воронку, отделяют верхний слой, представляющий собой раствор изопропилбензола в бензоле, промывают его 10%-ным раствором гидроксида натрия, потом водой до нейтральной реакции и сушат прокаленным хлоридом кальция. Высушенный раствор перегоняют из колбы Вюрца, отгоняя сначала бензол с водяным холодильником, а затем изопропилбензол с воздушным холодильником, собирая фракцию с т. кип. 151... 153°С,
Выход 10 г (73,5% от теоретического).
Изопропилбензол (кумол) — бесцветная жидкость, смешивается с эфиром, этиловым спиртом, ацетоном, хлороформом, бензолом. Температура кипения его 152,4°С, d =0,8618, n =1,4913, легко воспламеняется, т. всп. 38°С.
Спектр ЯМР: дублет 1,2 м. д., мультиплет 1,8 м. д., синглет 7,1.
Хроматография: на полосках слоя кремниевой кислоты с 5% крахмала, растворитель — н-гексан, не содержащий бензола. Rf= 0,62.
Способы получения:
- Кумол можно получить нагреванием бензола с изопропанолом при 65 С в течение 3-4 часов в присутствии 80% серной кислоты. Выход 80%. [Лит.1
 ]
]
C6H6 + (CH3)2CHOH → (CH3)2CHC6H5 + H2O
- Изопропилбензол промышленно получают алкилированием бензола пропиленом на хлориде алюминия. [Лит.1, Лит.2]
C6H6 + CH3CH=CH2 → C6H5CH(CH3)2
Реакции вещества:
- Реагирует с формальдегидом и хлороводородом с образованием 1-изопропил-4-(хлорметил)бензола. (выход 75%) [Лит.]
Показатель преломления (для D-линии натрия):
1,4915 (20°C)
1,4889 (25°C)
Давление паров (в мм рт.ст.):
0,01 (-44,4°C)
0,1 (-23,8°C)
0,144 (-20°C)
0,356 (-10°C)
0,807 (0°C)
1,7 (10°C)
3,34 (20°C)
6,22 (30°C)
10 (38,2°C)
11 (40°C)
18,62 (50°C)
30,31 (60°C)
47,63 (70°C)
72,54 (80°C)
107,4 (90°C)
155,02 (100°C)
218,65 (110°C)
301,98 (120°C)
409,19 (130°C)
544,86 (140°C)
714 (150°C)
Индекс удерживания для газовой хроматографии:
923,6 (фаза колонки - DB-5, со скоростью подъема температуры 6 К/мин)
Диэлектрическая проницаемость:
2,38 (20°C)
Дипольный момент молекулы (в дебаях):
0,85 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,075 (0°C)
0,915 (10°C)
0,788 (20°C)
0,737 (25°C)
0,691 (30°C)
0,611 (40°C)
Поверхностное натяжение (в мН/м):
28,2 (20°C)
27,67 (25°C)
27,14 (30°C)
26,09 (40°C)
25,03 (50°C)
22,4 (75°C)
19,76 (100°C)
Скорость звука в веществе (в м/с):
1342 (20°C, состояние среды - жидкость)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-41,3 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
197 (ж)Температура вспышки в воздухе (°C):
38Летальная доза (ЛД50, в мг/кг):
2900 (крысы, внутрижелудочно)
Критическая температура (в °C):
359,8Критическое давление (в МПа):
3,21Применение:
Применяют для производства фенола и ацетона. Как добавка для повышения октанового числа авиационного бензина.
Дополнительная информация::
Легко сульфируется, нитруется, галогенируется, алкилируется в ядро.
Источники информации:
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 585
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 597
- Воскресенский П.И., Каверина А.А., Парменов К.Я., Цветков Л.А., Эпштейн Д.А. Справочник по химии. - 4 изд. - М.: Просвещение, 1978. - С. 200
- Вредные химические вещества: Углеводороды, галогенпроизводные углеводородов. Справочник. - Л.: Химия, 1990. - С. 168-173
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 156
- Соколов В.З., Харлампович Г.Д. Производство и использование ароматических углеводородов. - М.: Химия, 1980. - С. 10-38
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 508
- Физико-химические свойства индивидуальных углеводородов. - М.: ГНТИНГТЛ, 1960. - С. 30-31, 64-65, 95, 142, 189, 236-238, 324, 336-337, 346, 375, 378, 395, 402, 408
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 194
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер