Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
пропан-2-он
Синонимы и иностранные названия:
2-пропанон (рус.)
acetone (англ.)
dimethyl ketone (англ.)
propan-2-one (англ.)
ацетон (рус.)
диметилкетон (рус.)
пропанон-2 (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C3H6OФормула в виде текста:
CH3COCH3CAS №: 67-64-1
Молекулярная масса (в а.е.м.): 58,079
Температура плавления (в °C):
-95,35Температура кипения (в °C):
56,24Температурные константы смесей (содержание в весовых процентах):
47 °C (температура кипения азеотропа, давление 1 атм) гексан 55% метанол 15% пропан-2-он 30%
51,1 °C (температура кипения азеотропа, давление 1 атм) метанол 16% пропан-2-он 43,5% циклогексан 40,5%
53,7 °C (температура кипения азеотропа, давление 1 атм) метанол 17,4% пропан-2-он 5,8% уксусной кислоты метиловый эфир 76,8%
55,7 °C (температура кипения азеотропа, давление 1 атм) метанол 15,5% пропан-2-он 84,5%
56,05 °C (температура кипения азеотропа, давление 1 атм) 3-бромпропен 8% пропан-2-он 92%
Растворимость (в г/100 г растворителя или характеристика):
1,1,1,2-тетрахлорэтан: смешивается [Лит.]
аммиак жидкий: смешивается [Лит.]
ацетон: смешивается [Лит.]
бензол: смешивается [Лит.]
вода: смешивается [Лит.]
диметилформамид: смешивается [Лит.]
диэтиловый эфир: смешивается [Лит.]
кислород жидкий: 0,00027 (-195,6°C) [Лит.]
метанол: смешивается [Лит.]
сульфолан: смешивается [Лит.]
тетрахлорметан: смешивается [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: смешивается [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
вода 26,4%, натрия гидроксид 0,3%, пропан-2-он 73,3%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 36,4%, натрия гидроксид 0,7%, пропан-2-он 62,9%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 41,5%, натрия гидроксид 1,1%, пропан-2-он 57,4%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 53,7%, натрия гидроксид 2,6%, пропан-2-он 43,7%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 65,5%, натрия гидроксид 5,3%, пропан-2-он 29,2%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 69%, натрия гидроксид 7%, пропан-2-он 24%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 75,4%, натрия гидроксид 9,4%, пропан-2-он 15,2%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 77,1%, натрия гидроксид 13,1%, пропан-2-он 9,8%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 76,4%, натрия гидроксид 17,2%, пропан-2-он 6,4%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 75,5%, натрия гидроксид 19,6%, пропан-2-он 4,9%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 73,4%, натрия гидроксид 24,3%, пропан-2-он 2,3%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 71,7%, натрия гидроксид 27,2%, пропан-2-он 1,1%, 0 °C, отделяющаяся фаза: при увеличении концентрации NaOH смесь разделяется на два жидких слоя [Лит.]
вода 19,5%, калия гидроксид 0,4%, пропан-2-он 80,1%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 28,8%, калия гидроксид 0,7%, пропан-2-он 70,5%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 45,3%, калия гидроксид 2%, пропан-2-он 52,7%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 53,9%, калия гидроксид 4,4%, пропан-2-он 41,7%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 65,2%, калия гидроксид 8,2%, пропан-2-он 26,6%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 73,8%, калия гидроксид 15,1%, пропан-2-он 11,1%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 73,8%, калия гидроксид 20,7%, пропан-2-он 5,5%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 70,8%, калия гидроксид 27,2%, пропан-2-он 2%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 70,3%, калия гидроксид 28,4%, пропан-2-он 1,3%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 55,8%, калия гидроксид 43,8%, пропан-2-он 0,4%, 0 °C, отделяющаяся фаза: при увеличении концентрации KOH смесь разделяется на два жидких слоя [Лит.]
вода 44,783%, магния хлорид 30,83%, пропан-2-он 24,387%, 20 °C [Лит.]
калия иодид 0,68%, пропан-2-он 96,518%, серебра иодид 2,802%, 25 °C [Лит.]
калия иодид 1,25%, пропан-2-он 93,73%, серебра иодид 5,02%, 25 °C [Лит.]
Плотность:
0,868 (-50°C, г/см3, состояние вещества - жидкость)
0,857 (-40°C, г/см3, состояние вещества - жидкость)
0,846 (-30°C, г/см3, состояние вещества - жидкость)
0,836 (-20°C, г/см3, состояние вещества - жидкость)
0,825 (-10°C, г/см3, состояние вещества - жидкость)
0,814 (0°C, г/см3, состояние вещества - жидкость)
0,802 (10°C, г/см3, состояние вещества - жидкость)
0,7908 (20°C, г/см3, состояние вещества - жидкость)
0,7899 (25°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Объем производства (тонн/год): 3000000 (в мире, 1980 г)
Поляризуемость молекул (нм3): 0,0066
Порог восприятия запаха в воздухе (мг/л): 0,0011
Скорость выгорания со свободной поверхности (кг/(м2·ч)): 66,36
Удельная электропроводность (См/см): 5,0E-7
Нормативные документы, связанные с веществом:
- ГОСТ Р ИСО № 16017-1-2007 "Воздух атмосферный, рабочей зоны и замкнутых помещений. Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 1. Отбор проб методом прокачки"
- Гигиенические нормативы (ГН) № 2.1.5.1315-03 "Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования " (Описание документа: ПДК в питьевой воде; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 2,2
- МУК № 4.1.598-96 "Методические указания по газохроматографическому определению ароматических, серусодержащих, галогенсодержащих веществ, метанола, ацетона и ацетонитрила в атмосферном воздухе"
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
- Методические рекомендации (МР) № 01.022-07 "Газохроматографическое определение ацетальдегида, ацетона, метилацетата, этилацетата, метанола, изо-пропанола, этанола, н-пропилацетата, н-пропанола, изо-бутилацетата, бутилацетата, изо-бутанола, н-бутанола, выделяющихся в воздушную среду из материалов различного состава"
- Методические рекомендации (МР) № 01.024-07 "Газохроматографическое определение гексана, гептана, ацетальдегида, ацетона, метилацетата, этилацетата, метанола, изо-пропанола, акрилонитрила, н-пропанола, н-пропилацетата, бутилацетата, изо-бутанола, н-бутанола, бензола, толуола, этилбензола, м-, о- и п-ксилолов, изопропилбензола, стирола, альфа-метилстирола в водных вытяжках из материалов различного состава"
- ПНД Ф № 14.1:2:4.201-03 "Методика выполнения измерений массовой концентрации ацетона и метанола в пробах питьевых, природных и сточных вод газохроматографическим методом"
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица III, с концентрацией 60% и более)
- Приказ федерального агентства по рыболовству № 20 от 18.01.2010 "Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения" (Описание документа: ПДК для водных объектов, имеющих рыбохозяйственное значение.)
- предельно допустимая концентрация (мг/л) в природной воде = 0,05 (токсикологический показатель)
Метод очистки или выделения из смесей 1:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 49Для высушивания ацетон помещают в колбу с обратным холодильником, закрытым хлоркальциевой трубкой, добавляют безводный хлорид кальция (120 г на 1 л) и кипятят, дважды заменяя осушитель через каждые 5-6 часов. Переливать ацетон на свежий осушитель следует как можно быстрее, так как ацетон очень жадно поглощает влагу. Окончательно ацетон перегоняют над хлоридом кальция.
Используется для синтеза веществ:
(E)-4-фенилбут-3-ен-2-он
1,2-O-изопропилиденглицерин
1,3,5-триметилбензол
1,5-диметилтетразол
1-бромпропан-2-он
1-хлорпропан-2-он
2-этоксикарбонил-5-кетогексановой кислоты этиловый эфир
4-(4-метоксифенил)бут-3-ен-2-он
4-гидрокси-4-метилпентан-2-он
N-(проп-2-илиден)гидроксиламин
ипразид
трихлорметан
этенон
Реакции вещества:
- Реагирует с малоновой кислотой при нагревании в присутствии пиридина с образованием 3-метилбут-2-еновой кислоты. (выход 60%) [Лит.]
(CH3)2CO + CH2(COOH)2 → (CH3)2C=CHCOOH + CO2 + H2O
- Реагирует с азотистоводородной кислотой с образованием N-метилацетамида. (выход 100%) [Лит.]
CH3COCH3 + HN3 → CH3CONHCH3 + N2
- Присоединяет синильную кислоту с образованием ацетонциангидрина. (выход 78%) [Лит.]
CH3COCH3 + HCN → (CH3)2C(OH)CN
- Присоединяет гидросульфит натрия с образованием бисульфитного соединения. (выход 56%) [Лит.]
CH3COCH3 + NaHSO3 → (CH3)2C(OH)SO3Na
- Реагирует с циклогексиламином в присутствии уксусной кислоты в бензоле с образованием N-циклогексилпропан-2-имина. (выход 95%) [Лит.]
CH3COCH3 + NH2C6H11 → (CH3)2C=NC6H11 + H2O
- Реагирует с гидроксиламином при рН около 4 с образованием оксима ацетона. [Лит.]
CH3COCH3 + NH2OH → (CH3)2C=NOH + H2O
- Конденсируется с формальдегидом и гидрохлоридом метиламина с образованием 4-[N-(2-ацетилэтил)-N-метиламино]бутан-2-она. (выход 56%) [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом 3,4-метилендиоксибензиламина с образованием 4-[N-(3,4-метилендиоксибензил)амино]бутан-2-она. (выход 20%) [Лит.]
- Реагирует с диметиловым эфиром броммалоновой кислоты и цинком с образованием диметилового эфира 2-(2-метил-4-оксопентан-2-ил)пропандиовой кислоты. [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом диметиламина с образованием 4-(диметиламино)-2-бутанона. [Лит.]
- Реагирует с хлоридом аммония и формальдегидом с образованием 3-ацетил-4-гидрокси-1,4-диметилпиперидина. [Лит.]
- Реагирует с анилином и бензальдегидом с образованием 1,2,6-трифенил-4-пиперидона. [Лит.]
- При действии концентрированной серной кислоты образует мезитилен. [Лит.]
- При стоянии с насыщением хлороводородом образовует окись мезитила и форон. [Лит.]
- Вступает в альдольную конденсацию под действием сильной щелочи с образованием диацетонового спирта. [Лит.]
- При действии иода и щелочей образует иодоформ и уксусную кислоту. [Лит.]
- Меркурируется нитратом ртути(II) в смеси с оксидом ртути(II) и безводным сульфатом кальция; при обработке продукта реакции иодидом калия получается иодид (ацетилметил)ртути. (выход 78%) [Лит.]
- При пиролизе (700 С) дает кетен и метан. [Лит.]
- Каталитически восстанавливается водородом до изопропанола. [Лит.]
- Амальгамами магния и цинка, а также цинком в уксусной кислоте восстанавливается до пинакона. [Лит.]
- Окисляет вторичные спирты в присутствии алкоголятов алюминия до кетонов (реакция Оппенгауэра). [Лит.]
- В присутствии сильной минеральной кислоты алкилирует фенол с образованием дифенилолпропана. [Лит.]
- Сильными окислителями (щелочной раствор перманганата калия или хромовая кислота) окисляется до муравьиной и уксусной кислот и далее до углекислого газа и воды. [Лит.]
- При нагревании с карбидом кальция в автоклаве при 150 С в течение 2 часов дает изофорон с высокомолекулярными продуктами конденсации. (выход 21,3%) [Лит.]
- Окисляется оксидом селена(IV) с образованием метилглиоксаля. (выход 60%) [Лит.]
- Конденсируется с этиловым эфиром циануксусной кислоты в присутствии ацетата аммония с образованием этилового эфира 3-фенил-2-цианбут-2-еновой кислоты. (выход 52%) [Лит.]
- Реагирует с амидом натрия давая натриевую соль, которая реагирует с ацетиленом с образованием натриевой соли 2-метилбут-3-ин-2-ола, который получают в свободном виде подкислением смеси. (выход 40%) [Лит.]
- Электрохимически восстанавливается в 20% серной кислоте до пропана. (выход 100%) [Лит.]
- Электрохимически восстанавливается на свинцовом катоде в кислой среде до изопропанола. [Лит.]
- При электрохимическом восстановлении на цинковом катоде образует 2,3-диметилбутан-2,3-диол. [Лит.]
- Дифенилолпропан получают реакцией фенола с ацетоном в присутствии кислот (серной, соляной). Выход 90-96%. [Лит.1]
2C6H5OH + (CH3)2CO → HOC6H4C(CH3)2C6H4OH + H2O
- Диацетилфуроксан был получен реакцией тетраоксида диазота с избытком ацетона и разложением неустойчивого промежуточного продукта. Выход 93%. [Лит.1, Лит.2]
2CH3COCH3 + 2N2O4 → CH3CO[C2N2O2]COCH3 + 2H2O + 2HNO2
- Кетен реагирует с ацетоном в присутствии серной кислоты с образованием изопропенилацетата. [Лит.1]
CH2=C=O + CH3COCH3 → CH3COOC(CH3)=CH2
- 2,2-Диэтоксипропан получают взаимодействием триэтилортоформиата и ацетона в абсолютном этаноле в присутствии следов п-толуолсульфокислоты. Выход 75%. [Лит.1]
- Пикриновая кислота реагирует с ацетоном и этанольным раствором гидроксида калия с образованием красного осадка дикалиевой соли 3-ацетонил-3-гидро-2,4,6-тринитрофенола. Выход 72%. [Лит.1]
- Под действием амида натрия и бромида лития ацетон конденсируется с образованием 4-гидрокси-4-метилпентан-2-она. Выход 60%. [Лит.1]
- Пероксид натрия воспламеняет ацетон, этилацетат, глицерин и изобутанол если они содержат небольшое количество воды. [Лит.1]
- Хромовый ангидрид воспламеняет при контакте: метанол, этанол, бутанол, изоамиловый спирт, изобутанол, диэтиловый эфир, уксусную кислоту, ацетон, ацетальдегид, бутаналь, бензальдегид, пропаналь, паральдегид, этилацетат, амилацетат, пеларгоновую кислоту. [Лит.1]
- Ацетон окисляется тетраацетатом свинца при кипячении в уксусной кислоте с образованием смеси α- и α,α'-ацетоксипроизводных. [Лит.1]
Реакции, в которых вещество не участвует:
- Не реагирует с N,N-диметил-п-фенилендиамином. [Лит.]
Показатель преломления (для D-линии натрия):
1,3591 (20°C)
1,3588 (25°C)
Свойства растворов:
5% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,125 (20°)
Плотность (г/см3) = 0,9912 (20°)
Показатель преломления для D-линии натрия = 1,3366 (20°)
Температура вспышки (°C) = 33
Температура замерзания (°C) = -1,63
10% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,244 (20°)
Плотность (г/см3) = 0,9849 (20°)
Показатель преломления для D-линии натрия = 1,3402 (20°)
Температура вспышки (°C) = 11
Температура замерзания (°C) = -3,29
18,16% (вес.), растворитель - вода
Температура замерзания (°C) = -6,55
20% (вес.), растворитель - вода
Температура вспышки (°C) = 1
30% (вес.), растворитель - вода
Температура вспышки (°C) = -5
31,18% (вес.), растворитель - вода
Температура замерзания (°C) = -12,35
50% (вес.), растворитель - вода
Температура вспышки (°C) = -11
70% (вес.), растворитель - вода
Температура вспышки (°C) = -14
85% (вес.), растворитель - вода
Температура вспышки (°C) = -17
95% (вес.), растворитель - вода
Температура вспышки (°C) = -19
Показатели диссоциации:
pKBH+ (1) = -7,2 (25°C, вода)
pKa (1) = 20 (20°C, вода)
Диэлектрическая проницаемость:
20,9 (20°C)
29,5 (-50°C)
28,1 (-40°C)
26,8 (-30°C)
25,6 (-20°C)
24,4 (-10°C)
23,3 (0°C)
22,2 (10°C)
Дипольный момент молекулы (в дебаях):
2,84 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,777 (-50°C)
0,657 (-40°C)
0,567 (-30°C)
0,496 (-20°C)
0,437 (-10°C)
0,391 (0°C)
0,36 (10°C)
0,295 (25°C)
0,29 (35°C)
0,28 (41°C)
Поверхностное натяжение (в мН/м):
23,7 (20°C)
Скорость звука в веществе (в м/с):
1189 (20°C, состояние среды - жидкость)
238,6 (97,1°C, состояние среды - газ)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-247,7 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
200 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
125 (ж)Энтальпия плавления ΔHпл (кДж/моль):
5,69Энтальпия кипения ΔHкип (кДж/моль):
29,1Температура вспышки в воздухе (°C):
-18Температура самовоспламенения на воздухе (°C):
465Теплота сгорания (кДж/моль):
1829,4Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-217,1 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-152,7 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
295,3 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
74,5 (г)Энтальпия растворения ΔHраств (кДж)
-30 (ж) [растворитель: вода, 17°C, 1 моль в 3,17 молях воды] [Лит.]
-25,63 (ж) [растворитель: вода, 17°C, 1 моль в 12,9 молях воды] [Лит.]
Летальная доза (ЛД50, в мг/кг):
3800 (кролики, перорально)
9750 (крысы, перорально)
Симптомы острого отравления:
При попадании внутрь и вдыхании паров - состояние опьянения, головокружение, слабость, шаткая походка, тошнота, боли в животе, коллапс, коматозное состояние. Возможны поражения печени (токсический гепатит) и почек (снижение диуреза, появление белка и эритроцитов в моче). При выходе из коматозного состояния часто развивается пневмония.
Лечение отравлений:
При пероральном приеме - промывание желудка, при ингаляционном - промывание глаз водой, ингаляция кислорода. Ощелачивание мочи. Форсированный диурез. Лечение острой сердечно-сосудистой недостаточности, нефропатии, пневмонии.
Симптомы острого отравления:
Угнетает нервную систему. Смертельная доза при приеме внутрь 50 г. Прием внутрь токсических доз вызывает раздражение желудочно-кишечного тракта, наркоз, повреждение печени и почек.
При вдыхании 1,2 мг/л в течение 3-5 мин развивается раздражение слизистых оболочек глаза, носа и горла, а вдыхание 0,01 мг/л в течение 6 ч повышало активность холинэстаразы крови и коэффициент использования кислорода. Увеличение содержания в крови кетоновых тел происходило при воздействии 0,001 мг/л; в моче содержание кетоновых тел не изменялось.
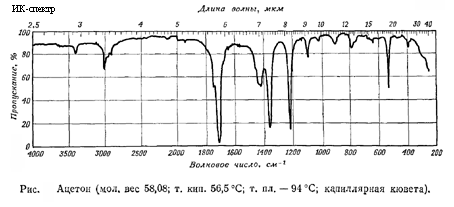
Спектральные свойства вещества:
Инфракрасный спектр (см-1) = 1220
Инфракрасный спектр (см-1) = 3005 ( валентные колебания C-H)
Инфракрасный спектр (см-1) = 2920 ( валентные колебания C-H)
Инфракрасный спектр (см-1) = 2960 ( валентные колебания C-H)
Инфракрасный спектр (см-1) = 1715 ( валентные колебания C=O)
Инфракрасный спектр (см-1) = 1420 ( деформационные колебания C-H)
Инфракрасный спектр (см-1) = 1363
Графические спектры вещества:
Инфракрасный спектр
Критическая температура (в °C):
235,5Критическое давление (в МПа):
4,7Критическая плотность (в г/см3):
0,273История:
Название от латинского acetum - уксус.
Дополнительная информация::
Не дает азеотропов с водой, этилформиатом, изопропилнитритом, диметоксиметаном, бутадиином, дикетеном, тиофеном, винилацетатом, уксусным ангидридом, масляным альдегидом, 2-бутаноном, диоксаном, этилацетатом, бутанолами, диэтиловым эфиром, бутиламином, пиридином, изопропенилацетатом, бензолом, фенолом, триэтиламином, бензойной кислотой.
При конденсации с ацетиленом дает 3-метил-3-бутинол, который легко переводится в изопрен. При конденсации ацетона с формальдегидом в присутствии небольшого количества щелочи образуется кетоспирт, который под действием иода или кислот при нагревании отщепляет воду с образованием винилметилкетона. Конденсируется с этилацетатом давая ацетилацетон. С аммиаком и водородом, в присутствии никеля или меди, при температуре 125-175 С и давлении 5-10 ат образует изопропиламин. С натрием или амидом натрия дает натриевую соль енольной формы ацетона.
Применение вещества:
- для синтеза диацетонового спирта [Лит.]
- для синтеза дифенилолпропана [Лит.]
- для синтеза изофорона [Лит.]
- для синтеза метилизобутилкетона [Лит.]
- для синтеза метилметакрилата [Лит.]
- для синтеза окиси мезитила [Лит.]
- для синтеза уксусного ангидрида [Лит.]
- растворитель [Лит.]
Источники информации:
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 22-23
- Milne G.W.A. Gardner's Commercially Important Chemicals. - Wiley-Interscience, 2005. - С. 7
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 175-184
- Smallwood I.M. Handbook of organic solvent properties. - 1996. - С. 171-173
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. - М.-Л.: Химия, 1964. - С. 138
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров. - М.: МЦФЭР, 2000. - С. 147
- Гордон А., Форд Р. Спутник химика. - М.: Мир, 1976. - С. 186
- Гутман В. Химия координационных соединений в неводных растворах. - М.: Мир, 1971. - С. 185-187 (ацетон как растворитель)
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 561
- Неотложная помощь при острых отравлениях: Справочник по токсикологии. - Под ред. Голикова С.Н. - М.: Медицина, 1977. - С. 261
- Огородников С.К., Лестева Т.М., Коган В.Б. Азеотропные смеси: Справочник. - Л.: Химия, 1971. - С. 60, 279-284
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 127
- Реакции и методы исследования органических соединений. - Кн. 13. - М.: Химия, 1964. - С. 145
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 230-231
- Шейхет Ф.И. Материаловедение химикатов, красителей и моющих средств. - М.: Легкая индустрия, 1969. - С. 62-71
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер


