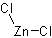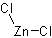Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
цинка хлорид
Синонимы и иностранные названия:
zinc chloride (англ.)
цинк хлористый (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
хлорид цинкаТип вещества:
неорганическое
Внешний вид:
бесцветн. тригональные кристаллыБрутто-формула (по системе Хилла для органических веществ):
Cl2ZnФормула в виде текста:
ZnCl2Молекулярная масса (в а.е.м.): 136,315
Температура плавления (в °C):
318Температура кипения (в °C):
732Температурные константы смесей (содержание в весовых процентах):
-56,54 °C (температура плавления эвтектической смеси) метилсульфонилметан 22,84% цинка хлорид 77,16%
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: не растворим [Лит.]
ацетон: 43,5 (18°C) [Лит.]
вода: 208 (0°C) [Лит.]
вода: 272 (10°C) [Лит.]
вода: 367 (20°C) [Лит.]
вода: 408 (25°C) [Лит.]
вода: 435 (30°C) [Лит.]
вода: 453 (40°C) [Лит.]
вода: 471 (50°C) [Лит.]
вода: 495 (60°C) [Лит.]
вода: 549 (80°C) [Лит.]
вода: 614 (100°C) [Лит.]
гидразин: 8 (20°C) [Лит.]
глицерин: 50 (15,5°C) [Лит.]
диметилсульфоксид: 30 (25°C) [Лит.]
диоксид серы: 0,16 (0°C) [Лит.]
диэтиловый эфир: хорошо растворим [Лит.]
метанол: растворим [Лит.]
оксид-дихлорид селена(IV) : 1,11 (25°C) [Лит.]
пиридин: 2,6 (20°C) [Лит.]
пропанол: растворим [Лит.]
пропиленкарбонат: 72 (25°C) [Лит.]
уксусная кислота: легко растворим [Лит.]
фтороводород: не растворим [Лит.]
этанол: 100 (12,5°C) [Лит.]
этилацетат: растворим [Лит.]
этиленкарбонат: 33 (40°C) [Лит.]
Плотность:
2,91 (25°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
гигроскопичен
Некоторые числовые свойства вещества:
Гигроскопическая точка (% относительной влажности): 3 (25 С)
Свойства растворов:
70% (вес.), растворитель - вода
Плотность (г/см3) = 1,962 (20°)
77,16% (вес.), растворитель - диметилсульфон
Плотность (г/см3) = 2,1 (90°)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-415,05 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-369,4 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
111,5 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
71,33 (т)Энтальпия плавления ΔHпл (кДж/моль):
10,25Энтальпия кипения ΔHкип (кДж/моль):
119,2Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-266 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
277 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
56,9 (г)Энтальпия растворения ΔHраств (кДж)
-65,79 (т) [растворитель: вода, 18°C, 1 моль в 400 молях воды] [Лит.]
Применение:
При ситцепечатании, в промышленности органических красителей. В смеси с оксидом цинка - компонент зубных цементов или замазки не изменяющей объем при застывании. Обрабатывают бумагу для получения растительного пергамента.
Дополнительная информация::
Концентрированные водные растворы хлорида цинка растворяют крахмал, целлюлозу и шелк.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 4-99
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1582-1583
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 373-374
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 532
- Некрасов Б.В. Основы общей химии. - Т.2. - М.: Химия, 1973. - С. 199
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 113
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 262, 793-794
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 256-257
- Якименко Л.М. Производство хлора, каустической соды и неорганических хлорпродуктов. - М.: Химия, 1974. - С. 572-578
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер